實驗室常用的干燥劑“堿石灰”是CaO和NaOH固體的混合物,極易與空氣中水蒸氣和CO
2反應而變質.同學們為確認一瓶久置的“堿石灰”樣品的成分,進行如下實驗探究.
(1)【猜想】
猜想Ⅰ:沒有變質,“堿石灰”中只含有CaO、固體NaOH;
猜想Ⅱ:已完全變質,“堿石灰”全部變成了CaCO
3和 Na
2CO
3(2)【實驗】如圖所示:
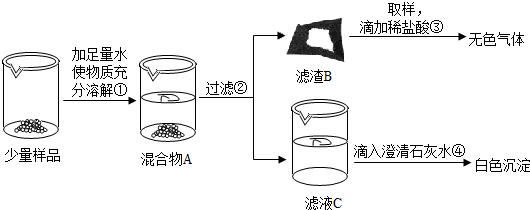
實驗過程中,同學們還發現向樣品中加入足量水溶解時放出大量的熱.
(3)【判斷】
a.若Ca(OH)
2、CaCO
3和Na
2CO
3溶于水無明顯的溫度變化,則猜想Ⅱ
不成立
不成立
;(填“成立”或“不成立”)
b.操作③發生反應的化學方程式為
CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
;
由操作④的現象判斷:濾液C中的溶質一定含有
Na2CO3
Na2CO3
(寫化學式);
由此判斷猜想Ⅰ
不成立
不成立
(填“成立”或“不成立”)
c.綜合a和b的結論,判斷該樣品變質情況為
部分變質
部分變質
(填“全部變質”或“部分變質”)
下列對樣品成分的分析正確的是
②③
②③
(填序號).
①樣品中一定含NaOH
②樣品中一定含Na
2CO
3③樣品中含NaOH、CaO中的一種或兩種
【拓展】由上述實驗說明,實驗室中“堿石灰”應
密封
密封
保存;操作②中玻璃棒的作用是
引流
引流
.



 橄欖油 B.
橄欖油 B. 蔬菜 C.
蔬菜 C. 米飯
米飯