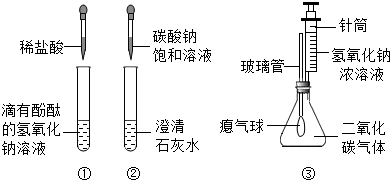
某興趣小組在學習堿的化學性質時,進行了如下所示的實驗.
(1)實驗①中鹽酸和氫氧化鈉反應的化學方程式為
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
.
(2)實驗②中觀察到試管內有白色沉淀產生,反應的化學方程式為
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
.
(3)實驗③中滴加氫氧化鈉溶液后,可觀察到的現象是
氣球脹大
氣球脹大
.
實驗結論:堿能與多種類別的物質發生反應,包括指示劑、非金屬氧化物、酸和鹽類等.
【反思交流】實驗結束后,同學們對實驗②的廢液成分進行了探究:將實驗②的廢液進行過濾,濾渣所含的成分是
碳酸鈣
碳酸鈣
.
【提出問題】濾液中所含溶質是什么物質呢?
【做出猜想】猜想一:濾液中的溶質是氫氧化鈉.
猜想二:濾液中的溶質是氫氧化鈉和碳酸鈉.
猜想三:濾液中的溶質是氫氧化鈉和
氫氧化鈣
氫氧化鈣
.
【實驗設計】同學們取濾液樣品并加入酚酞溶液,溶液呈紅色,繼續逐滴加入稀鹽酸,發現溶液逐漸變無色,同時有氣泡產生.由此得出結論,猜想
二
二
正確.

