
科目: 來源: 題型:實驗探究題
查看答案和解析>>
科目: 來源: 題型:實驗探究題
| 實驗操作 | 實驗現象 | 實驗結論 |
| 取少量反應后的溶液于試管中,加入鋅粒 | 沒有氣泡產生. | 兩種物質恰好完全反應 |
查看答案和解析>>
科目: 來源: 題型:填空題
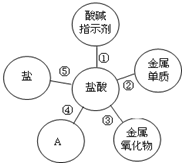 歸納是學習的重要方法,小紅在復習鹽酸的性質時歸納出鹽酸的五條化學性質(如圖所示,連線表示相互反應).
歸納是學習的重要方法,小紅在復習鹽酸的性質時歸納出鹽酸的五條化學性質(如圖所示,連線表示相互反應).查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題

| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
查看答案和解析>>
科目: 來源: 題型:解答題
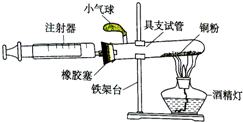 某化學興趣小組在實驗室利用自己設計的裝置(如圖)測定空氣中氧氣的含量.
某化學興趣小組在實驗室利用自己設計的裝置(如圖)測定空氣中氧氣的含量.查看答案和解析>>
科目: 來源: 題型:解答題
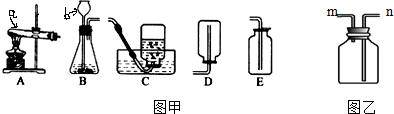
查看答案和解析>>
科目: 來源: 題型:解答題

 ,寫離子符號S2-,該元素的原子核外有3個電子層,它屬于非金屬元素(填“金屬”或“非金屬”),在化學反應中易得到(填“得到”或“失去”)電子.
,寫離子符號S2-,該元素的原子核外有3個電子層,它屬于非金屬元素(填“金屬”或“非金屬”),在化學反應中易得到(填“得到”或“失去”)電子.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com