
分析 根據質量守恒定律得出產生二氧化碳氣體的質量為6.0g+20g-23.8g=2.2g,再根據二氧化碳的質量和化學反應方程式CaCO3+2HCl═CaCl2+H2O+CO2↑求出碳酸鈣的質量,根據質量分數公式進一步求出雞蛋殼中碳酸鈣的質量分數.
解答 解:(1)根據質量守恒定律得出產生二氧氣體的質量為:10g+40g-47.8g=2.2g;
(2)設雞蛋殼中碳酸鈣的質量為X.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$
x=5g
$\frac{5g}{10g}×$100%=50%
答案:
(1)生成二氧化碳的質量為:2.2g;
(2)石灰石樣品中碳酸鈣的質量為50%.
點評 此題是質量分數與化學方程式的綜合計算,首先要正確寫出方程式,再根據題意仔細分析各量關系,認真計算,方可求解.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:選擇題
| A. | 澄清的石灰水變渾濁 | |
| B. | 汽油揮發 | |
| C. | 碳在空氣中燃燒生成二氧化碳 | |
| D. | 向膽礬的溶液中加入氫氧化鈉溶液生成藍色沉淀 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
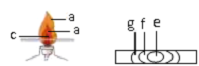 如圖是探究酒精燈燈焰結構及性質的實驗示意圖:
如圖是探究酒精燈燈焰結構及性質的實驗示意圖:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 銅在潮濕的空氣中有綠色物質生成 | B. | 鐵絲彎曲 | ||
| C. | 固體碘受熱后變成紫紅色碘蒸氣 | D. | 車輪爆胎 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com