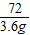甲醇(CH3OH)是一種有毒、有酒精氣味可燃性液體.甲醇在氧氣中完全燃燒反應表示為:2CH3OH+nO2=mCO2+pH2O(其中n、m、p表示化學計量數),若反應生成3.6g水.試計算:
(1)m值是______;
(2)參加反應的氧氣的質量是多少克?(請寫出規范的計算步驟)
【答案】
分析:(1)根據質量守恒定律,在化學反應前后原子的種類和數目都沒有改變.由已知反應物中C原子總數為2,生成物中C原子總數也應該為2,則可以求得m=2,反應物中氫原子的個數為8,所以p的值為4,再由生成物氧原子總數和甲醇中氧原子總數可以求出n=3.
(2)由方程式中可以找出參加反應的氧氣和生成水的質量比,再由生成水的質量可以求得參加反應的氧氣質量.
解答:解:(1)根據質量守恒定律,在化學反應前后原子的種類和數目都沒有改變.由已知反應物中C原子總數為2,生成物中C原子總數也應該為2,則可以求得m=2,反應物中氫原子的個數為8,所以p的值為4,再由生成物氧原子總數和甲醇中氧原子總數可以求出n=3.
(2)設參加反應的氧氣質量為X
2CH
3OH+3O
2
2CO
2+4H
2O
96 72
x 3.6g
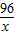
=
解得:x=4.8g
答:參加反應的氧氣的質量是4.8g.
故答案為:(1)3;
(2)4.8g.
點評:解此類題要依據質量守恒定律,化學反應前后元素種類及原子個數不變,分別統計出反應前后有關原子種類及個數,比較分析可以得出m、n、p的值;從而可以寫出完整的化學方程式,再根據方程式中各物質之間的質量關系,就可以求出某種未知的物質的質量.

 2CO2+4H2O
2CO2+4H2O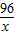 =
=