
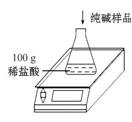
工業上侯氏制堿法制得的純堿產品中常含有少量的氯化鈉雜質,化驗員要對每批次的純堿產品進行檢驗。在實驗室中取27 g純堿樣品,平均分成五份依次加入到盛有100 g稀鹽酸的錐形瓶中(錐形瓶的質量為60 g),每次充分反應后都進行稱量,得到的實驗數據如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入純堿樣 品的質量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 電子天平 的示數/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入純堿樣品充分反應后,生成二氧化碳的質量是 g。
(2)計算純堿樣品中碳酸鈉的質量分數是多少?(計算結果精確到0 .1%)
.1%)
(3)計算所用稀鹽酸的質量分數是多少?
【解析】本題主要結合數據表格考查有關化學方程式的計算。(1)結合數據表格,可知第一次純堿樣品完全反應后生成二氧化碳的質量為5.4 g+100 g+
60 g-163.2 g=2.2 g;(2)(3)由于每5.4 g樣品完全反應能產生2.2 g二氧化碳,根據第三次產生6.6 g二氧化碳可以判斷第三次樣品完全反應,又根據第四次的質量沒有 變化,說明第三次的酸也完全反應,因此第三次加入的純堿樣品與100 g鹽酸恰好完全反應,共生成二氧化碳6.6 g,根據碳酸鈉與鹽酸反應的化學方程式,由二氧化碳的質量可以計算碳酸鈉的質量及氯化氫的質量,從而可以計算純堿樣品中碳酸鈉的質量分數和所用稀鹽酸的質量分數
變化,說明第三次的酸也完全反應,因此第三次加入的純堿樣品與100 g鹽酸恰好完全反應,共生成二氧化碳6.6 g,根據碳酸鈉與鹽酸反應的化學方程式,由二氧化碳的質量可以計算碳酸鈉的質量及氯化氫的質量,從而可以計算純堿樣品中碳酸鈉的質量分數和所用稀鹽酸的質量分數 。
。
答案:(1)2.2
(2)(3)第三次加入純堿樣品后與100 g鹽酸恰好完全反應,其生成二氧化碳的質量為6.6 g
設前三次加入的純堿樣品中共含有碳酸鈉的質量為x。
100 g稀鹽酸中含HCl的質量為y
Na2CO3+2HCl====2NaCl+CO2↑+H2O
106 36.5×2 44
x y  6.6 g
6.6 g
106∶44=x∶6.6 g x=15.9 g
73∶44=y∶6.6 g y=10.95 g
純堿樣品中碳酸鈉的質量分數為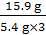 ×100%≈98.1%
×100%≈98.1%
所用稀鹽酸的質量分數為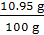 ×100%=10.95%
×100%=10.95%
答:純堿樣品中碳酸鈉的質量分數為98.1%,所用稀鹽酸的質量分數為10.95%。


科目:初中化學 來源: 題型:
| 操作步驟 | 現象 | 結論 |
| (1)取該晶體加熟石灰研磨 | 無氨味 | 猜想 3和5 3和5 不成立 |
| (2)另取該晶體加入鹽酸 | 有氣泡產生 有氣泡產生 |
猜想1不成立 |
| (3)另取少量該晶體加水溶解,再滴入氯化鈣溶液 | 無白色沉淀 | 猜想4不成立 |
(4)另取該固體放入如圖試管中加熱 |
包有硫酸銅的棉花變 藍色 藍色 色,石灰水變渾濁 渾濁 |
綜合(1)、(2)、(3)的結論得出猜想2成立 |
| ||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com