
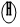 和
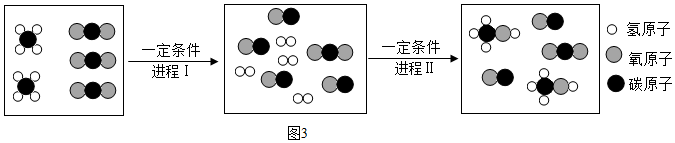
和  分別表示氫原子和氧原子,下圖是水在通電條件下發生反應的微觀模擬圖.
分別表示氫原子和氧原子,下圖是水在通電條件下發生反應的微觀模擬圖.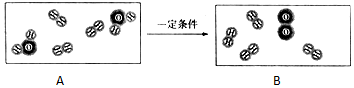
科目:初中化學 來源: 題型:解答題
 利用如圖裝置我們認識了水的組成:
利用如圖裝置我們認識了水的組成:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
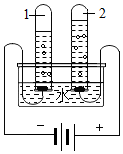
 甲、乙、丙三種物質的溶解度曲線如圖所示.根據圖中信息回答下列問題:
甲、乙、丙三種物質的溶解度曲線如圖所示.根據圖中信息回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
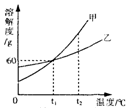
| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 向l00g水中加入60g甲充分攪拌后能形成飽和溶液 | |
| C. | 甲中混有少量乙時,可以用蒸發溶液的方法獲得較純凈的乙 | |
| D. | t2℃甲的飽和溶液降低溫度后溶解度減小,溶質的質量分數也減小 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
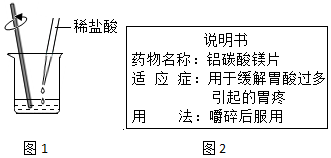
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
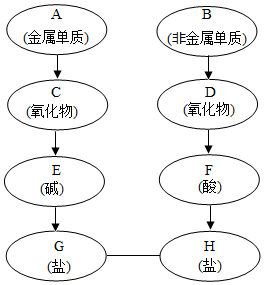 A~H分別是氫、氧、碳、氮、鈉、鈣六種元素中的一種或幾種組成的初中化學常見物質(如圖所示.箭頭表示物質間能轉化,實線表示物質間能反應).請回答:
A~H分別是氫、氧、碳、氮、鈉、鈣六種元素中的一種或幾種組成的初中化學常見物質(如圖所示.箭頭表示物質間能轉化,實線表示物質間能反應).請回答:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
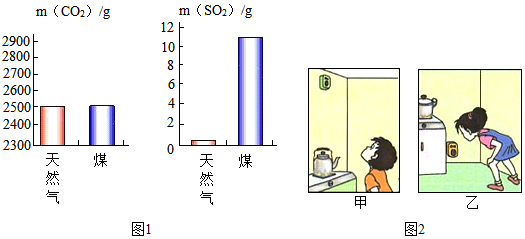
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ①③④ | B. | ①③⑤ | C. | ②④ | D. | ②⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com