
老師要求同學們將30g
NaCl樣品中的雜質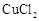 除去,同時測出其中所含
除去,同時測出其中所含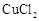 的質量分數。提供的試劑有:一定質量分數的NaOH溶液、KOH溶液、稀鹽酸各100g。小林同學順利完成了任務。她的方法是:將30g NaCl樣品加入100g水中,固體全部溶解后再逐漸加入所選試劑,當加入的試劑質量為56g時,恰好完全反應,測得生成沉淀的質量為4.9g。請回答:
的質量分數。提供的試劑有:一定質量分數的NaOH溶液、KOH溶液、稀鹽酸各100g。小林同學順利完成了任務。她的方法是:將30g NaCl樣品加入100g水中,固體全部溶解后再逐漸加入所選試劑,當加入的試劑質量為56g時,恰好完全反應,測得生成沉淀的質量為4.9g。請回答:
(1)小林同學所選用的試劑是 。
(2)該NaCl樣品中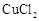 的質量分數是多少?
的質量分數是多少?
(3)當恰好完全反應時,所得溶液的質量是多少?
(1)氫氧化鈉溶液 (2)22.5% (3)181.1g
【解析】
試題分析:(1)根據除雜的原則,所選的物質要與氯化銅發生反應而不與氯化鈉發生反應,在除去氯化銅的同時還不能混入其它雜質;氫氧化鈉與氯化鈉不反應,氫氧化鈉與氯化銅反應生成氫氧化銅沉淀和氯化鈉,使用氫氧化鈉溶液可以在除去氯化銅的同時又得到主要物質氯化鈉,可以達到實驗目的;若使用氫氧化鉀,氫氧化鉀與氯化銅反應生成氫氧化銅沉淀和氯化鉀,在除去氯化銅的同時又混入新雜質氯化鉀;若使用稀鹽酸,鹽酸與雜質氯化銅不反應,無法除雜;故選氫氧化鈉溶液。
(2)根據題意,寫出氯化銅與氫氧化鈉反應的化學方程式,再根據氫氧化銅沉淀的質量求出氯化銅的質量,最后利用樣品中氯化銅的質量分數= ×100%,即可求出氯化鈉樣品中氯化銅的質量分數。
×100%,即可求出氯化鈉樣品中氯化銅的質量分數。
解,設氯化銅的質量為x
CuCl2+2NaOH=2NaCl+Cu(OH)2↓
135 98
x 4.9g
135:x="98:4.9g"
解得,x=6.75g
則該NaCl樣品中CuCl2的質量分數=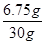 ×100%="22.5%"
×100%="22.5%"
(3)根據題意,當恰好完全反應時,所得溶液為氯化鈉溶液,所得溶液的質量=所加的所有物質的總質量-生成沉淀的質量,故所得溶液的質量=30g+100g+56g-4.9g=181.1g
答:當恰好完全反應時,所得溶液的質量為181.1g。
考點:物質除雜或凈化的探究,根據化學反應方程式的計算
點評:一般的除雜質題必須同時滿足兩個條件:①加入的試劑只能與雜質反應,不能與原物質反應,②反應時不能加入新的雜質,這是正確解題的關鍵;至于根據化學方程式的計算,本題較簡單,只要會利用相關的化學反應方程式,并依據已知量對未知的應求量進行求解計算即可,注意要有完整的計算步驟和規范的書寫格式。


 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:初中化學 來源: 題型:
30.(7分)某校的一堂初中化學課:首先,老師在一只干燥的小燒杯中放幾粒氫氧化鈉固體,讓同學們觀察。發現白色的氫氧化鈉固體很快表面變潮并粘在一起。然后,老師要求學生自己動手配制100g2.5%的氫氧化鈉溶液。其中甲同學的實驗操作如下:
(1)稱取2.5g固體氫氧化鈉:在天平的兩端各放一張質量相同的紙,調整天平零點,然后在左盤放2g砝碼,游碼移至0.5g處,往右盤加氫氧化鈉固體至天平平衡。
(2)配制溶液:用量筒量取100mL水,然后將氫氧化鈉加入量筒中,邊加邊攪拌。教師對甲同學進行了指導,甲同學糾正了自己操作中的四處錯誤:
①________________________________________________;
②________________________________________________;
③________________________________________________;
④________________________________________________;
(3)最后,老師讓學生討論:設計至少3種方案(至少有一種方案含化學變化),不需要混合物的分離,也不引入其他雜質,將100g的2.5%的氫氧化鈉溶液變為5%的氫氧化鈉溶液。同學們展開了熱烈的討論,所提可行方案如下:
________________________________________;
_______________________________________;
_______________________________________;
________________________________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com