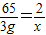3克不純鋅(含金屬M)和3克不純的鐵(含金屬N)分別與足量的稀硫酸充分反應后,都得到0.1克氫氣,則M、N可能是( )
A.M為Fe,N為Mg
B.M為Al,N為Ag
C.M為Mg,N為Zn
D.M為Cu,N為Al
【答案】
分析:根據金屬與酸反應的化學方程式,采用極值法計算出產生氫氣的質量,再進行分析比較.
解答:解:設3g純鋅與足量稀硫酸充分反應放出H
2的質量為x
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
3g x
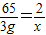
解之得x≈0.09g<實際產生的氫氣質量0.1g
則3g不純的鋅中所含的雜質M也能與稀硫酸反應生成H
2,且3g純M反應生成H
2的質量大于0.1g,故M的相對原子質量比Zn的相對原子質量(65)小.
同理分析,N的相對原子質量應比Fe的相對原子質量(56)大,或者N不能與稀硫酸反應置換出H
2.符合條件的有BC兩項.
故選BC.
點評:化合價相同的兩種活潑金屬與足量酸溶液反應生成氫氣的質量與其相對原子質量成正比.