
分析 (1)①根據工業制硫酸的流程為:FeS2$→_{煅燒}^{空氣}$SO2$→_{高溫、催化劑}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4因為其中有二氧化硫氣體生成,則可推測工業制H2SO4可能會引起的環境問題.
②考慮在實驗室中事故的緊急處理方法.
(2)考慮中和反應,利用化學方程式進行計算.
解答 解:
(1)①根據工業制硫酸的流程為:FeS2$→_{煅燒}^{空氣}$SO2$→_{高溫、催化劑}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4,因為其中有二氧化硫氣體生成,則可推測工業制H2SO4可能會引起的環境問題為形成酸雨(或造成空氣污染);
②因為濃硫酸的腐蝕性主要是由它的脫水性和強氧化性引起的,而碳酸氫鈉溶液顯堿性,故在實驗室中不慎將濃硫酸沾到皮膚上的緊急處理方法為立即用大量水沖洗,然后再涂上3%-5%的碳酸氫鈉溶液中和殘余硫酸.氫氧化鈉和硫酸反應,反應的化學方程式為:2NaOH+H2SO4═Na2SO4+2H2O;
(2)沉淀不再產生,說明恰好中和,則此時液體的pH=7.
設化工產品中殘留Ba(OH)2的質量為x.
Ba(OH)2+H2SO4═BaSO4↓+2H2O
171 98
x 100g×9.8%
$\frac{171}{x}=\frac{98}{100g×9.8%}$
解得x=17.1g
答:化工產品中殘留Ba(OH)2的質量為17.1g.
故答案為:
(1)形成酸雨(或造成空氣污染);A;2NaOH+H2SO4═Na2SO4+2H2O;
(2)7;17.1g.
點評 熟悉濃硫酸除具有酸的通性外,還有強氧化性、吸水性、脫水性,吸水性和脫水性的區別:吸水性吸的是游離態的水,脫水性脫的是氫氧原子按2:1形成的水.掌握利用化學方程式進行計算的方法步驟.


科目:初中化學 來源: 題型:選擇題
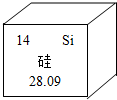
| A. | “Si”表示硅的元素符號 | |
| B. | “14”指的是硅元素的原子序數 | |
| C. | “硅”是元素名稱,硅屬于非金屬元素 | |
| D. | “28.09”指一個硅原子的質量是基準碳原子質量的28.09倍 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
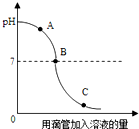 實驗小組探究鹽酸和氫氧化鈉反應過程中溶液pH的變化規律,得到如圖所示曲線.下列有關該實驗事實的說法不正確的是( )
實驗小組探究鹽酸和氫氧化鈉反應過程中溶液pH的變化規律,得到如圖所示曲線.下列有關該實驗事實的說法不正確的是( )| A. | 該實驗是將鹽酸溶液滴入氫氧化鈉中 | |
| B. | B點表示鹽酸和氫氧化鈉恰好完全反應 | |
| C. | A點時的溶液能使酚酞試液變紅 | |
| D. | C點時,溶液中的溶質只有氯化鈉 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 焚燒廢舊塑料以解決“白色污染”問題 | |
| B. | 大力發展太陽能等新型能源 | |
| C. | 使用節能的建筑材料 | |
| D. | 免費教材的循環使用 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com