
分析 (1)據甲醇的化學式分和相對分子質量計算公式進行解答;
(2)據甲醇完全燃燒的方程式分析解答;
(3)①據化學反應前后原子的種類和數目不變計算m的值;
②據生成水的質量和反應方程式中氧氣和水的質量關系計算參加反應的氧氣的質量.
解答 解:(1)根據相對分子的質量為組成分子的各原子的相對原子質量之和,可得甲醇的相對分子質量為:12+1×X+16=32,解得X=4;
(2)甲醇完全燃燒時,生成二氧化碳和水,反應方程式是:2X+3O2 $\frac{\underline{\;點燃\;}}{\;}$2CO2+4H2O,
其中生成二氧化碳和水的質量比為:【2×(12+16×2)】:【4×(1×2+16)】=11:9;
(3)①根據質量守恒定律:在化學反應中,反應前后原子的種類沒有改變,數目沒有增減,據方程式8CHxO+nO2$\frac{\underline{\;點燃\;}}{\;}$mCO2+2CO+16H2O,反應前有8個碳原子,反應后有了2個碳原子,還少6個碳原子,故m=6,反應前有8個氧原子,反應后30個氧原子,還少22個氧原子,所以n=11,由(2)可知x=4,則方程式為8CH4O+11O2$\frac{\underline{\;點燃\;}}{\;}$6CO2+2CO+16H2O;
②設參加反應氧氣的質量為y
8CH4O+11O2$\frac{\underline{\;點燃\;}}{\;}$6CO2+2CO+16H2O
352 288
y 3.6g
$\frac{352}{y}$=$\frac{288}{3.6g}$
解得:y=4.4g
答:參加反應的氧氣質量是4.4g.
故答案為:(1)4;
(2)11:9.
(3)①6;
②4.4g.
點評 本題考查學生對質量守恒定律的理解與應用,對化合物中各元素質量比、質量分數、方程式計算方法的掌握,要據題意細心分析解答.


科目:初中化學 來源: 題型:解答題
 圖是市售某品牌牙膏包裝盒上的部分說明.其主要活性成分單氟磷酸鈉(Na2PO3F)是牙膏的常用添加劑之一,試驗表明牙膏中單氟磷酸鈉的質量分數達到0、76%~0、80%時,防齲齒的效果較好.試求:
圖是市售某品牌牙膏包裝盒上的部分說明.其主要活性成分單氟磷酸鈉(Na2PO3F)是牙膏的常用添加劑之一,試驗表明牙膏中單氟磷酸鈉的質量分數達到0、76%~0、80%時,防齲齒的效果較好.試求:查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
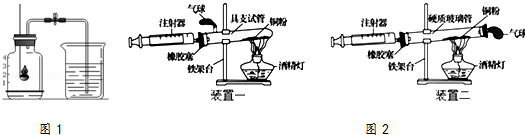
| 硬質玻璃管中空氣的體積 | 反應前注射器中空氣體積 | 充分反應后注射器中氣體體積 | 實驗測得空氣中氧氣的體積分數 |
| 25mL | 15mL | 9mL | ? |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 實驗操作 | 實驗現象 | 實驗結論 | 方法提煉 |
| 點燃木條,在火焰上方罩一干燥的冷燒杯 | 一會兒燒杯內壁有水霧產生. | 木條中一定含有 氫元素 | a、根據實驗現象 可以推測出實驗結論. b、本實驗是根據 生成物的組成來判斷木條的組成的. |
| 繼續把火焰靠近燒杯底部 | 一會兒燒杯底部出現一層黑色物質 | 木條中一定含有 碳元素 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com