
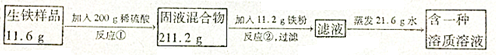
分析 鐵和稀硫酸反應生成硫酸亞鐵和氫氣,第一次反應前后的質量差即為反應生成氫氣的質量,根據氫氣的質量可以計算其它數據,進一步可以進行相關方面的計算;
溶液稀釋前后,溶質質量不變.
解答 解:(1)鐵和稀硫酸反應的化學方程式為:Fe+H2SO4═FeSO4+H2↑.
故填:Fe+H2SO4═FeSO4+H2↑.
(2)設鐵的質量為X,①中參加反應的硫酸質量為y,反應生成硫酸亞鐵的質量為z,
反應生成氫氣的質量為:11.6g+200g-211.2g=0.4g,
Fe+H2SO4═FeSO4+H2↑,
56 98 152 2
X y z 0.4g
$\frac{56}{X}$=$\frac{98}{y}$=$\frac{152}{z}$=$\frac{2}{0.4g}$,
X=11.2g,y=19.6g,z=30.4g,
故填:$\frac{56}{X}$=$\frac{2}{0.4g}$.
(3)該生鐵樣品中鐵的純度為:$\frac{11.2g}{11.6g}$×100%=96.6%.
故填:96.6%.
(4)因為反應①結束后,所加稀硫酸剛好反應一半,反應②恰好完全反應,因此反應生成硫酸亞鐵總質量為:30.4g+30.4g=60.8g,
反應后溶液質量為:11.2g+200g+11.2g-21.6g-0.4g=200.4g,
則所得濾液中溶質的質量分數為:$\frac{60.8g}{200.4g}$×100%=30.3%,
故填:30.3%.
(5)設需要水的質量為m,
稀硫酸的質量分數為:$\frac{19.6g}{100g}$×100%=19.6%,
需要濃硫酸質量為:(200g×19.6%)÷98%=40g,
需要加入水的質量為:200g-40g=160g.
故填:160g.
點評 本題主要考查學生運用假設法和化學方程式進行計算和推斷的能力,同時考查了分析數據的能力,計算時要注意規范性和準確性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:選擇題
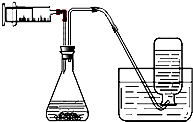
| A. | 石灰石與稀鹽酸制取、收集二氧化碳(可溶于水) | |
| B. | KClO3與MnO2制取、收集氧氣 | |
| C. | KMnO4制取、收集氧氣 | |
| D. | 過氧化氫溶液與MnO2制取、收集氧氣 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com