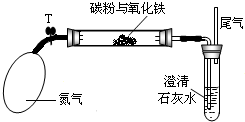
某學生研究性學習小組對一定量木炭粉與三氧化二鐵反應產物中氣體成分進行研究.
I:假設:該反應的氣體產物全部是二氧化碳.
II:設計方案:將一定量三氧化鐵在隔絕氧氣的條件下與一定量木炭粉完全反應,測定參加反應的碳元素與氧元素的質量比,計算出反應產物中碳、氧原子的數目比.
III.研閱資料:氮氣不與碳、三氧化二鐵發生反應,可用來隔絕氧氣.實驗室可以用飽和氯化銨(NH4C1)溶液和飽和亞硝酸鈉
(NaNO2)溶液混合加熱反應制得氮氣,產物中還有氯化鈉和水.
(1)寫出制取氮氣反應的化學方程式______ NaCl+2H2O+N2↑
【答案】
分析:III.研閱資料:(1)根據提供的反應物和生成物書寫化學方程式;
(2)根據反應物的狀態和反應條件選擇制取裝置;
IV:碳做還原劑時裝置中要隔絕空氣,避免碳發生燃燒,因此用氮氣把整個裝置內的空氣排出去.檢驗二氧化碳時要用澄清的石灰水.
VI:結論:根據數據處理,參加反應的碳元素質量為0.48g,氧元素質量為0.96g,本實驗中碳氧兩元素的質量比為0.48g:0.96g=1:2,原假設不成立.
解答:解:III(1)氯化銨(NH
4C1)溶液和飽和亞硝酸鈉(NaNO
2)溶液混合加熱反應生成氮氣,產物中還有氯化鈉和水,反應的化學方程式為:NaNO
2+NH
4C1
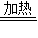
NaCl+2H
2O+N
2↑;
(2)該反應需要加熱液體,故實驗裝置與實驗室用MnO
2和濃鹽酸加熱反應制C1
2 的相同.
IV:(1)實驗前要檢查裝置的氣密性,防止裝置漏氣;
(3)通入氮氣的目的是:排盡裝置中的空氣,避免氧氣產生干擾.
(4)試管中的石灰水是用來檢驗二氧化碳的,加熱一段時間,澄清石灰水變渾濁,該現象說明木炭和氧化鐵反應有二氧化碳氣體生成;
VI:結論:在數據處理中,題目告訴我們的信息是:經計算,參加反應的碳元素質量為0.48g,氧元素質量為0.96g,兩元素的質量比為0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的質量比為3:8,故不是純的二氧化碳氣體.
故答案為:III(1)NaNO
2+NH
4C1

NaCl+2H
2O+N
2↑;
(2)B;
IV:(1)檢查裝置的氣密性;
(3)排盡裝置中的空氣,避免氧氣產生干擾.
(4)木炭和氧化鐵反應有二氧化碳氣體生成;
VI:結論:經計算,參加反應的碳元素質量為0.48g,氧元素質量為0.96g,兩元素的質量比為0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的質量比為3:8,故不是純的二氧化碳氣體.
點評:本考點屬于實驗探究題,既有實驗方法和過程的探究,又有實驗數據的分析和結論的探究,綜合性比較強.要記住單質碳的可燃性和還原性,希望同學們認真分析,綜合掌握.本考點主要出現在實驗題中.

 NaCl+2H2O+N2↑;
NaCl+2H2O+N2↑; NaCl+2H2O+N2↑;
NaCl+2H2O+N2↑;