
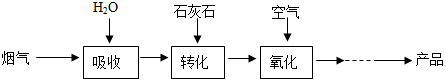
分析 (1)根據將煙氣中的SO2直接排放到空氣中,可能會導致酸雨,根據二氧化硫能使高錳酸鉀溶液褪色進行分析;
(2)根據碳酸鈣和亞硫酸反應會生成亞硫酸鈣、水和二氧化碳進行分析;
(3)根據亞硫酸鈣和氧氣反應生成硫酸鈣,反應前后各元素的化合價進行分析;
(4)根據硫酸鈣分解的反應原理分析解答;
(5)二氧化硫與碳酸鈣反應生成亞硫酸鈣與二氧化碳,亞硫酸鈣在水存在的條件下被氧氣氧化生成CaSO4•2H2O;根據關系式S~SO2~CaSO4•2H2O來計算;
(6)根據不利于脫硫的影響因素進行分析;
解答 解:
(1)將煙氣中的SO2直接排放到空氣中,可能會導致酸雨;可用使高錳酸鉀溶液檢驗煙氣中二氧化硫;
(2)碳酸鈣和亞硫酸反應會生成亞硫酸鈣、水和二氧化碳,所以設備2中,加入CaCO3的目的是將H2SO3轉化為CaSO3;反應的化學方程式是:CaCO3+H2SO3═CaSO3+SO2↑+H2O; 基本類型是復分解反應;
(3)亞硫酸鈣和氧氣反應生成硫酸鈣,化學方程式為:2CaSO3+O2+4H2O=2(CaSO4•2H2O)或2CaSO3+O2=2CaSO4;
(4)硫酸鈣在高溫條件下會分解生成二氧化硫和另外2種生成物,其中一種是金屬氧化物.硫酸鈣分解的化學方程式是:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑;
(5)二氧化硫與碳酸鈣反應生成亞硫酸鈣與二氧化碳,反應方程式為:SO2+CaCO3=CaSO3+CO2,亞硫酸鈣在水存在的條件下被氧氣氧化生成CaSO4•2H2O,反應方程式為:2CaSO3+O2+4H2O=2(CaSO4•2H2O),總反應為:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
故答案為:SO2+CaCO3=CaSO3+CO2;2CaSO3+O2+4H2O=2(CaSO4•2H2O);
S~SO2 ~CaSO4•2H2O
32 172
200t×2.5%×96% m
$\frac{32}{200t×2.5%×96%}=\frac{172}{m}$
m=25.8t
(6)在整個轉化過程中,不利于脫硫的影響因素是煙塵含量過高和煙氣溫度過高;
答案:
(1)形成酸雨; 高錳酸鉀;
(2)使亞硫酸完全轉化為亞硫酸鈣; CaCO3+H2SO3═CaSO3+SO2↑+H2O; 復分解反應;
(3)2CaSO3+O2+4H2O=2(CaSO4•2H2O)或2CaSO3+O2=2CaSO4
(4)2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑;
(5)25.8;
(6)bc
點評 本題考查了燃料脫硫的原理等,題中難度中等,注意化學方程式的書寫,為該題的易錯點和難點.注意流程分析和設計方法和理解是解答的關鍵.


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:初中化學 來源: 題型:填空題
 甲、乙、丙三種物質的溶解度曲線如圖所示,根據圖中信息回答下列問題:
甲、乙、丙三種物質的溶解度曲線如圖所示,根據圖中信息回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | CaCO3$\frac{\underline{\;高溫\;}}{\;}$ CaO+CO2↑ | B. | 2H2+O2 $\frac{\underline{\;點燃\;}}{\;}$2H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+3CO2 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 金屬鈉保存在煉油中以隔絕空氣和水 | |
| B. | 鈉與水反應放熱,使鈉熔化,鈉是熔點較低的金屬 | |
| C. | 鈉和水反應的化學方程式為 2Na+2H2O═2NaOH+H2↑ | |
| D. | 把鈉投入硫酸銅溶液中會產生紅色物質,溶液褪為無色 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | K2MnO4、KMnO4、MnO2三者中Mn元素的化合價逐漸升高 | |
| B. | HCl、NaCl、Na2CO3溶液的pH逐漸變大 | |
| C. | NH4NO3、NaCl、CaO三者溶于水后,所得溶液的溫度逐漸降低 | |
| D. | 將Zn、Fe兩金屬片分別放入CuSO4溶液中可以證明三種金屬的活動性順序為Zn>Fe>Cu |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com