
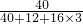 ×100%=40%;
×100%=40%;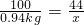
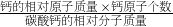 ×100%”計算出碳酸鈣中鈣元素的質量分數,然后再乘以珍珠中含碳酸鈣的質量分數,就是珍珠中鈣元素的質量分數;
×100%”計算出碳酸鈣中鈣元素的質量分數,然后再乘以珍珠中含碳酸鈣的質量分數,就是珍珠中鈣元素的質量分數;

 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:初中化學 來源: 題型:解答題
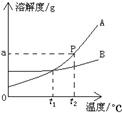
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
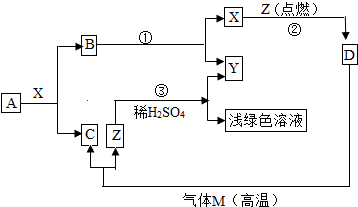
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com