
【題目】初中階段:物質得氧和失氧的反應是氧化還原反應;高中階段:凡是有元素化合價升降的化學反應都是氧化還原反應。元素化合價升高的為還原劑,發生氧化反應;元素化合價降低的為氧化劑,發生還原反應;氧化反應和還原反應同時發生的,這樣的反應稱為氧化還原反應。請回答下列問題。
(1)根據化合價改變判斷下列四種基本反應類型,一定不是氧化還原反應的是_____。(選填序號)
A 化合反應 B 分解反應 C 置換反應 D 復分解反應
(2)下列化學反應中屬于氧化還原反應的是_____(選填序號),該反應的還原劑是_____(填化學式)。
A Na2CO3+CaCl2═CaCO3↓+2NaCl
B Fe+CuSO4═Cu+FeSO4
C Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
D CaO+H2O=Ca(OH)2
【答案】D B Fe
【解析】
(1)四種基本類型的反應分別是置換反應、化合反應、分解反應和復分解反應等,氧化還原反應的特征為有元素化合價的升降,以此解答該題。
(2)根據反應中含元素的化合價變化,為氧化還原反應解答;
(3)氧化反應與還原反應在同一元素間進行,則反應中只有一種元素的化合價變化,以此來解答。
(1)A.有單質參加反應的化合反應為氧化還原反應,如氫氣和氧氣的反應,故不選;
B.有單質生成的分解反應為氧化還原反應,故不選;
C.置換反應有單質參與,元素的化合價一定發生變化,屬于氧化還原反應,故不選。
D.復分解反應一定不是氧化還原反應,不存在元素化合價的變化,故選D;
(2)A.沒有元素的化合價變化,不屬于氧化還原反應,故A選項不正確;
B.反應前Fe、Cu元素的化合價分別為:0、+2,反應后Fe、Cu元素的化合價分別為:+2、0,有元素的化合價變化,屬于氧化還原反應,該反應的還原劑是Fe;故選項正確;
C、沒有元素的化合價變化,不屬于氧化還原反應,故C選項不正確;
D、沒有元素的化合價變化,不屬于氧化還原反應,故D選項不正確;
故答為:(1)D;(2)B,Fe。


科目:初中化學 來源: 題型:
【題目】在一次化學實驗課上,老師讓同學們對兩個實驗進行探究。
實驗一:探究氫氧化鈉溶液中是哪一種粒子能使無色酚酞溶液變色
[猜想]可能是水分子、鈉離子或氫氧根離子使無色酚酞溶液變色。
[實驗]
(1)在第一支試管中加入約2 mL蒸餾水,滴入幾滴無色酚酞溶液。現象:溶液不變色;
(2)在第二支試管中加入約2 mL氯化鈉溶液,滴入幾滴無色酚酞溶液。現象:____;
(3)在第三支試管中加入約2 mL氫氧化鈉溶液,滴入幾滴無色酚酞溶液。現象:________。
[結論]____。
實驗二:用注射器向充滿某種氣體的軟塑料瓶中注入一種液體(如圖),振蕩,發現塑料瓶變癟,探究氣體和液體可能是什么物質?

[猜想]氣體和液體可能是_____(寫一組即可)。
[實驗]用試管取少量實驗后塑料瓶中的溶液,加入試劑___,產生相應的現象,其化學方程式為____。
[評價]上述實驗完成后,能否驗證你的猜想_____,理由是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】小明對鐵的銹蝕進行如下探究,室溫時,將包有樣品的濾紙包用大頭針固定在橡膠塞上,迅速塞緊,裝置如圖,觀察到量筒內水沿導管慢慢進入廣口瓶(凈容積為146 mL)。當溫度恢復至室溫,且量筒內水面高度不變時讀數(此時瓶內氧氣含量近似為零)。記錄起始和最終量筒的讀數以及所需時間如表
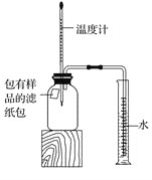
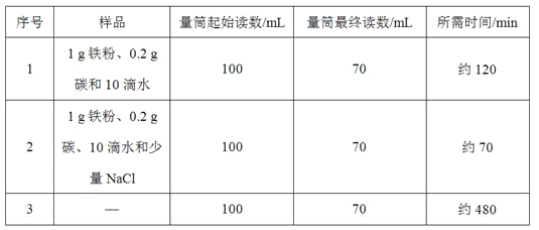
(1)實驗①和②說明NaCl可以____鐵銹蝕的速率。
(2)實驗開始后,廣口瓶內溫度有所上升,說明鐵的銹蝕過程是____(填“放熱”或“吸熱”)過程。
(3)實驗結束后取出濾紙包,觀察到有紅棕色物質生成,該物質的化學式是______。
(4)已知碳能夠加快鐵的生銹速度,小明想通過實驗①和③是探究碳對鐵銹蝕速率的影響,請在表格空白處填寫實驗③的樣品組成___。
(5)該裝置還可用于測量空氣中氧氣的含量,根據上述數據計算氧氣的體積含量是___(小數點后保留1位)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列圖象能正確反映其對應關系的是
A. 向等質量、等質量分數的稀硫酸中加入足量的鎂、鋁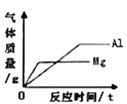
B. 向一定量稀硫酸和硫酸鈉的混合液中滴加氯化鋇溶液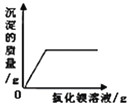
C. 向一定量的氫氧化鈉溶液中滴加pH=2的稀硫酸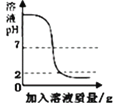
D. 等質量CaCO3分別與等體積等質量分數的稀鹽酸(足量)反應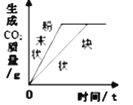
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖的加熱袋常用于野外加熱食物。加熱袋中的固體粉末含鎂粉、鐵粉和氯化鈉,使用時向其中加入水袋中的水,即可產生大量熱。實驗小組針對放熱過程中的反應原理展開探究。


【查閱資料】
常溫下鎂粉能與水發生置換反應,且放熱。
【進行實驗】
同學們用下圖所示裝置進行模擬實驗:分別取不同成分的固體粉末放入甲中,通過分液漏斗向其中均加入8 mL水,讀取甲中所得固液混合物的最高溫度,實驗記錄如下表:
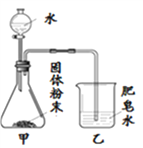
(實驗時的室溫為22.8℃)
實驗序號 | A | B | C | D | E | F |
固體成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中現象 | 少量肥皂泡,難以點燃 | ______ | 少量肥皂泡,難以點燃 | 較多肥皂泡,點燃有爆鳴聲 | 無肥皂泡 | 大量肥皂泡,點燃有爆鳴聲 |
混合物溫度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解釋與結論】
(1)實驗B,乙中現象為_______________。
(2)實驗A證明了鎂粉與水能反應,完成該反應的化學方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使鎂粉與水迅速反應并放熱的最佳方法是向鎂粉中加入_____________。
【反思改進】
(4)同學們分析實驗數據發現,升高的溫度沒有達到食品加熱袋的效果,其可能的原因是___________。
(5)同學們根據實驗結果進一步猜測,實驗F中的反應結束后,甲中剩余固體混合物中仍然含有鐵粉,檢驗其鐵粉存在的的實驗方案為:取少量固體混合物________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】資源、能源與環境已成為人們日益關注的問題
(1)化石燃料包括煤、石油和____,是不可再生能源。汽油中加入乙醇作汽車燃料可節省石油資源,寫出乙醇燃燒的化學方程式____。
(2)汽車尾氣中含有一氧化氮和二氧化硫,會污染大氣。請寫出這兩種氣體的化學式并標出氮、硫元素的化合價____、____。
(3)下列行為會增加空氣中PM2.5的是____。
A.治理工地揚塵 B.電廠排放煤煙 C.使用公共自行車 D.禁止焚燒秸稈
(4)氫氣是未來的能源,目前尚不能廉價制取。實驗室用鋅與稀硫酸反應制得0.4g氫氣,至少需要消耗鋅的質量是多少?(寫出計算過程)______
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】等質量的AB兩種金屬,分別與質量分數相同的足量的稀鹽酸反應(已知,AB在生成物中均為+2價),生成氫氣的質量隨反應時間的變化關系如圖所示,下列判斷正確的是()
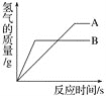
A. 金屬活動性順序:A>B
B. 相對原子質量:A>B
C. 反應結束后,所得溶液質量:A>B
D. 反應結束后,生成氫氣質量:A>B
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】工業上制造高純度CaO的主要流程示意圖如下:
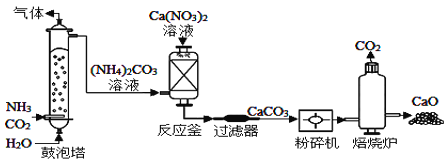
(1)CaCO3物質類別屬于_____
(2)反應釜中的反應屬于復分解反應,其化學方程式是_____。
(3)碳酸鈣進入焙燒爐前,先要粉碎的目的是_____,最后取出的CaO要立即放入干燥器,其原因是_____(用化學方程式表示)。
(4)理論上5tCaCO3制出CaO的質量是多少t?_____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com