(2004?汕頭)食醋是家庭常用的調味品.某同學欲探究食醋中醋酸的質量分數.該同學進行了這樣的實驗:取10%的氫氧化鈉溶液(密度為1.1g/mL)逐滴加入到200 g食醋中,至恰好完全反應,共用去10%的氫氧化鈉溶液50 mL.已知反應化學方程式如下:CH3COOH+NaOH=CH3COONa+H2O
求:(1)該50mL氫氧化鈉溶液中溶質質量;
(2)食醋中醋酸的質量分數(計算結果精確到0.1%).
【答案】
分析:(1)由氫氧化鈉溶液的密度、體積和質量分數可以計算出氫氧化鈉溶液中溶質氫氧化鈉的質量.
(2)由氫氧化鈉和食醋的質量根據化學方程式可以計算出食醋中醋酸的質量分數.
解答:解:(1)50mL氫氧化鈉溶液中溶質質量為
50mL×1.1g/mL×10%=5.5g
(2)設食醋中醋酸的質量分數為x.
CH
3COOH+NaOH=CH
3COONa+H
2O
60 40
200g?x 5.5g
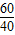
=
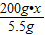
,x≈4.1%
答:食醋中醋酸的質量分數為4.1%.
點評:本題主要考查含雜質物質的化學方程式計算和溶質質量分數的計算,難度較大.

 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案