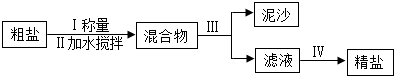
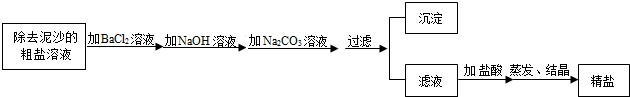
精鹽(NaCl)和純堿(Na2CO3)是家庭廚房中兩種常見物質.
(1)用化學方法區別精鹽和純堿,可以選擇下列哪一種物質?答:______.
A.白酒 B.鹽酸 C.純凈水 D.醬油
(2)已知:Na2CO3+H2SO4→Na2SO4+H2O+CO2↑,現有精鹽(NaCl)和純堿 (Na2CO3)兩種固體混合物53克,加入足量的稀硫酸,充分反應后,生成4.4克二氧化碳氣體,則該固體混臺物中純堿(Na2CO3)的質量是多少克?該固體混合物中氯化鈉的質量分數是多少?
【答案】
分析:(1)氯化鈉和碳酸鈉兩種物質都是白色固體,所以不能通過觀察顏色來判斷.但它們兩種物質所含的陰離子不同,所以可以根據陰離子不同來鑒別.
(2)向碳酸鈉的氯化鈉的固體混合物中加硫酸,氯化鈉不與硫酸反應而碳酸鈉與硫酸反應生成硫酸鈉、水和氣體二氧化碳;根據反應中生成二氧化碳的質量,利用反應的化學方程式可計算出混合物中碳酸鈉的質量,再計算氯化鈉的質量,后求得固體混合物中氯化鈉的質量分數.
解答:解:(1)精鹽(NaCl)和純堿(Na
2CO
3)均溶于純凈水,現象相同,故不能用溶解法來區分.化學反應的現象是多種多樣的,所以可以根據化學反應的現象不同來區分.故答案為:各取少許精鹽和純堿于試管中,滴入2毫升稀鹽酸,如果有能使澄清石灰水變渾濁的氣體產生,證明該物質是純堿,而另一種物質是精鹽.
故選B
(2)設固體混合物中Na
2CO
3的質量為x,
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 44
x 4.4g
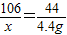
x=
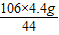
=10.6g
該固體混合物中NaCl的質量:53g-10.6g=42.4g
固體混合物中NaCl的質量分數:
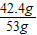
×100%=80%
答:固體混合物中Na
2CO
3的質量為10.6g;固體混合物中NaCl的質量分數為80%.
點評:氯化鈉和純堿若是在廚房中的,我們可以選擇用品嘗的方法來區分.但沒有指明時,不能用品嘗的方法.此題主要考查根據化學方程式的計算,需注意計算步驟的規范、完整性.

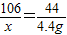
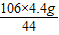 =10.6g
=10.6g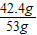 ×100%=80%
×100%=80%