碘與鎂化合成碘化鎂(MgI2),反應很慢,滴入水后反應速率加快,這反應的化學方程式為:______
工業上用石灰石等物質為原料制取輕質碳酸鈣(較純的碳酸鈣).寫出生產過程中的三個反應的化學方程式:______
(1)銅器在潮濕的空氣中生成一層銅綠:______
(2)質子數小于18的正二價金屬元素的單質在空氣中燃燒,發生化合反應,可生成兩種物質.一種物質能溶于鹽酸,此物質的化學式是______,另一種物質能與水反應生成氫氧化物和氨氣,此物質的化學式是______.
解:碘與鎂化合成碘化鎂(MgI
2),反應很慢,滴入水后反應速率加快,反應的化學方程式為I
2+Mg
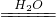
MgI
2.
煅燒石灰石生成氧化鈣和二氧化碳,反應的化學方程式為:CaCO
3
CaO+CO
2↑;氧化鈣和水反應生成氫氧化鈣,反應的化學方程式為:CaO+H
2O═Ca(OH)
2;氫氧化鈣和二氧化碳反應生成碳酸鈣沉淀和水,反應的化學方程式為:CO
2+Ca(OH)
2═CaCO
3↓+H
2O.
銅在潮濕的空氣中生成銅綠(Cu
2(OH)
2CO
3)是銅與空氣中的水、氧氣、二氧化碳共同作用的結果,反應的化學方程式為:2Cu+CO
2+O
2+H
2O═Cu
2(OH)
2CO
3.
在質子數小于18的元素中化合價為+2價的金屬,其核外最外層電子數應該為2,只有鎂元素滿足該條件;鎂是較為活潑的金屬,不僅能夠與空氣中的氧氣發生反應,生成氧化鎂,氧化鎂能與酸反應;而且還能與氮氣反應反應生成氮化鎂,氮化鎂能與水反應生成氫氧化鎂和氨氣.在氧化鎂中,由于氧元素顯-2價,鎂元素為+2價,根據化合價的代數和為零,可得其化學式為MgO.氮化鎂中,鎂為+2價,則氮元素只能為負價的,由于原子最外層為5個電子,所以其負價為-3價,根據化合價的代數和為零可得其化學式為Mg
3N
2.
故答案為:I
2+Mg
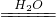
MgI
2;CaCO
3
CaO+CO
2↑;CaO+H
2O═Ca(OH)
2;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;2Cu+CO
2+O
2+H
2O═Cu
2(OH)
2CO
3;MgO;Mg
3N
2.
分析:首先根據反應原理找出反應物、生成物、反應條件,根據化學方程式的書寫方法、步驟進行書寫即可.
在質子數小于18的元素中化合價為+2價的金屬,其核外最外層電子數應該為2,只有鎂元素滿足該條件,鎂是較為活潑的金屬,不僅能夠與空氣中的氧氣發生反應,而且還能與氮氣反應反應.
點評:本題難度不大,掌握化學方程式的書寫方法、熟悉常見元素的化合價以及核外電子排布情況是正確解答本題的關鍵.

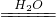 MgI2.
MgI2. CaO+CO2↑;氧化鈣和水反應生成氫氧化鈣,反應的化學方程式為:CaO+H2O═Ca(OH)2;氫氧化鈣和二氧化碳反應生成碳酸鈣沉淀和水,反應的化學方程式為:CO2+Ca(OH)2═CaCO3↓+H2O.
CaO+CO2↑;氧化鈣和水反應生成氫氧化鈣,反應的化學方程式為:CaO+H2O═Ca(OH)2;氫氧化鈣和二氧化碳反應生成碳酸鈣沉淀和水,反應的化學方程式為:CO2+Ca(OH)2═CaCO3↓+H2O.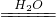 MgI2;CaCO3
MgI2;CaCO3 CaO+CO2↑;CaO+H2O═Ca(OH)2;CO2+Ca(OH)2═CaCO3↓+H2O;2Cu+CO2+O2+H2O═Cu2(OH)2CO3;MgO;Mg3N2.
CaO+CO2↑;CaO+H2O═Ca(OH)2;CO2+Ca(OH)2═CaCO3↓+H2O;2Cu+CO2+O2+H2O═Cu2(OH)2CO3;MgO;Mg3N2.
