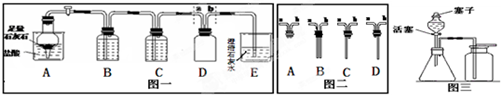
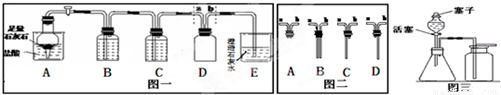
解:【甲組同學實驗】
(1)鹽酸具有揮發性,會揮發氯化氫氣體,所以B中盛放試劑的作用為除去二氧化碳中混有的氯化氫氣體,裝置C盛放的試劑為濃硫酸,目的是除去二氧化碳中混有的水蒸氣,裝置A中是鹽酸和碳酸鈣反應生成氯化鈣、水二氧化碳,反應的化學方程式為CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;裝置E中是二氧化碳和氫氧化鈣反應生成碳酸鈣和水,反應的化學方程式為CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(2)二氧化碳的密度比空氣的密度大,與集氣瓶D匹配最合適的帶導管的橡皮塞是圖二中的C;
【乙組同學實驗】
漏斗中的水沒有流下不能說明裝置氣密性好,因為分液漏斗上面的塞子沒有打開,水根本不可能流下,該裝置制取氧氣用到的藥品是雙氧水和二氧化錳,化學方程式為
2H
2O
2
2H
2O+O
2↑.
故答案為:【甲組同學實驗】
(1)除去二氧化碳中混有的氯化氫氣體;濃硫酸;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;
(2)C;
【乙組同學實驗】否;2H
2O
2
2H
2O+O
2↑.
分析:【甲組同學實驗】
(1)根據鹽酸具有揮發性,會揮發氯化氫氣體,所以B中盛放試劑的作用為除去二氧化碳中混有的氯化氫氣體以及裝置C盛放的試劑為濃硫酸進行解答;
(2)根據二氧化碳的密度比空氣的密度大進行解答;
【乙組同學實驗】
根據漏斗中的水沒有流下不能說明裝置氣密性好,因為分液漏斗上面的塞子沒有打開,水根本不可能流下以及該裝置制取氧氣用到的藥品是雙氧水和二氧化錳進行解答.
點評:本考點考查了實驗探究的步驟、現象和化學方程式的書寫等.實驗室三大氣體的發生裝置和收集裝置的選擇、驗證和驗滿是中考的重要考點之一,一定要掌握.書寫化學方程式時,要注意配平.


 2H2O+O2↑.
2H2O+O2↑. 2H2O+O2↑.
2H2O+O2↑.

 24、某班同學在實驗室選用下列裝置進行CO2的制取和性質驗證的分組實驗.
24、某班同學在實驗室選用下列裝置進行CO2的制取和性質驗證的分組實驗.