
【題目】探究實驗發現規律
(1)探究影響物質溶解性的因素.
實驗一 | 實驗二 |
|
|
實驗一目的是探究__________對硝酸鉀溶解性的影響; 實驗二觀察到的實驗現象為氯化鈉溶解于水,不能溶解于酒精中。該實驗的目的是探究__________對氯化鈉溶解性的影響.
(2)運用溶解度曲線信息回答下列問題:甲、乙、丙三種物質(均不含結晶水)的如圖所示,

①20℃時,甲、乙、丙三種物質溶解度由大到小的順序為__________。
②在__________時,甲和乙兩物質的溶解度相等。若丙中混有少量甲,可將其溶液__________結晶,趁 熱過濾以提純丙。
③50℃時,將等質量的甲、乙、丙三種物質的飽和溶液同時降溫至 10℃,所得溶液中溶質質量分數最小的是__________。
【答案】溫度 不同溶劑 乙>甲>丙 40℃ 蒸發 丙
【解析】
(1)實驗一硝酸鉀溶于水,觀察溶解情況,然后用酒精燈加熱,觀察溶解情況,實驗過程中溫度不同,該實驗的目的是探究溫度對硝酸鉀溶解性的影響;
實驗二觀察到的現象為氯化鈉溶解于水中,不能溶解于酒精中。該實驗的目的是探究不同溶劑對氯化鈉溶解性的影響;
(2)①從20℃向上做垂線,與曲線的交點在上面的溶解度就大,所以20℃時它們的溶解度大小順序是乙>甲>丙;
②在40℃時,甲和乙兩物質的溶解度相等。丙溶解度隨溫度的增加而減少,甲溶解度隨溫度的增加而增加,故若丙中混有少量甲,可將其溶液蒸發結晶,趁熱過濾以提純丙。
③由于飽和溶液的質量分數與溶解度有關,溶解度大的溶質質量分數就大,所以在50℃時甲、乙、丙三種物質的飽和溶液的質量分數大小是:甲>乙>丙,溫度降低到10℃,甲和乙都析出晶體仍然飽和,但10℃乙的溶解度大于甲的,所以此時乙的溶質質量分數大于甲的,丙降溫后變為不飽和,所以溶質質量分數不變,主要比較一下甲在10℃時溶解度與丙在50℃的溶解度大小就行,通過比較丙是小的,所以溶質質量分數最小的是丙;


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:初中化學 來源: 題型:
【題目】向200gAgNO3溶液中加入m克Fe和Cu的混合粉末,攪拌,充分反應后過濾、洗滌、干燥得21.6g固體。向濾液中滴加NaCl溶液,產生白色沉淀。下列說法正確的是( )
A.濾液的質量是178.4g
B.混合粉末的質量范圍是5.6g<m<6.4g
C.固體中加入稀鹽酸可能會有氣體生成
D.原AgNO3溶液的溶質質量分數是17%
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗課上,同學們利用下列裝置進行氣體制備的學習。請回答下列問題:
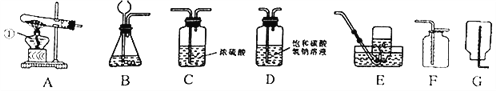
(1)編號①的儀器名稱是_____。
(2)用加熱法制取氧氣,所選擇的發生裝置是_____ (填字母,下同),收集裝置是_____,反應的化學方程式為_____。
(3)若要制取瓶純凈、干燥的二氧化碳氣體 (常混有少量氯化氫氣體和水蒸氣,裝置連接的正確順序是:產生氣體→_____→_____→F.檢驗二氧化碳氣體的方法是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】現有6.4gM和氧氣充分反應,生成4.4gCO2 、2.8gCO和7.2g水。則參加反應的氧氣的質量為______克;此反應的化學方程式為_______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】右圖所示,某河旁甲、乙、丙、丁四座化工廠排放的工業廢水中分別含有碳酸鈉、氯化銅、氫氧化鈉、鹽酸中的一種.某同學對①、②、③、④處水質監測時記錄了以下現象.根據現象推斷,甲、乙、丙、丁四座化工廠排放工業廢水的成分,錯誤的是( )
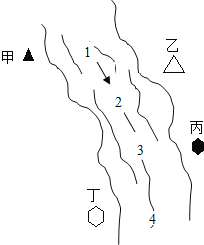
① | ② | ③ | ④ | |
記錄現象 | 無色溶液 | 藍色渾濁 | 渾濁消失 | 產生氣泡 |
A.甲:碳酸鈉 B.乙:氯化銅 C.丙:鹽酸 D.丁:碳酸鈉
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國科學家研究出碳化鉬負載金原子的催化體系,使CO和H2O在120℃下發生反應,其微觀過程如圖所示。下列說法正確的是( )

A.圖中僅有1種金屬元素的原子
B.反應前后分子種類、數目均不變
C.金原子對CO起吸附催化作用
D.反應的化學方程式為:CO+H2O=H2 +CO2
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在過氧化氫溶液的分解反應中,某化學興趣小組發現:除了二氧化錳,硫酸銅溶液也能對H2O2的分解起催化作用。對此,他們進行了有關探究。
(提出問題)CuSO4溶液是混合物,是其中哪一種成分起到了催化作用呢?
(查閱資料)①稀硫酸中主要含有H2O、H+、SO42三種微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42三種微粒。
(作出猜想)根據以上信息,同學們作出了如下三個猜想:
Ⅰ:SO42催化分解H2O2 Ⅱ:Cu2+催化分解H2O2 Ⅲ:H2O催化分解H2O2
(1)其中,明顯不合理的是_______(填序號),理由是_______。
(實驗驗證)
(2)為了驗證自己的猜想,同學們設計了如下兩個實驗(所取H2O2溶液的濃度相同):
操作 | 現象 | 結論 |
取5 mL H2O2溶液于試管中,滴入少量的稀硫酸,伸入帶火星的木條 | _______ | SO42對H2O2的分解不起催化作用 |
_______ | 產生大量氣泡,帶火星的木條復燃 | _______ |
(實驗拓展)
實驗一:用圖甲裝置探究影響H2O2分解速率的因素,得到圖乙、圖丙所示曲線(在等溫條件下,產生氧氣體積與裝置內壓強成正比,反應放熱忽略不計)。
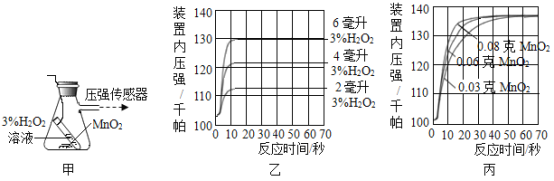
(3)寫出圖甲中反應的化學方程式_______。
(4)圖乙是“0.1 g MnO2與不同體積的3% H2O2溶液混合”的實驗結果,從圖中可以看出_______。
(5)圖丙是用“8 mL濃度為3%的H2O2溶液與不同質量的MnO2混合”時,所得到的曲線,通過該曲線可以得到的結論是_______。
實驗二:用圖丁裝置探究氧氣的濃度對燃燒的影響。點燃蠟燭后立即塞緊橡皮塞,待蠟燭熄滅后,將滴管中的水全部滴入瓶中,鋁盒中的白磷燃燒。
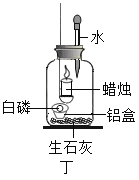
(6)白磷燃燒的主要現象是_______。
(7)由“蠟燭熄滅,白磷燃燒”可得出的結論是_______。
(8)滴入水后白磷燃燒的原因是_______。
查看答案和解析>>
科目:初中化學 來源: 題型:
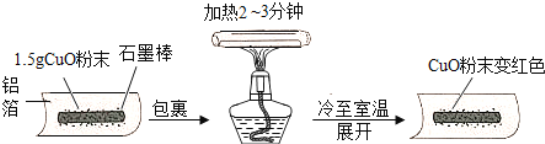
【題目】.某興趣小組在做完碳還原氧化銅實驗后,進行了如圖的探究:
[猜想]把氧化銅還原成銅的物質是:Ⅰ.石墨棒;Ⅱ.________.
[實驗]用天平稱量1.5g氧化銅粉末,直接用鋁箔紙包裹.按上述操作步驟實驗,黑色粉末________,那么猜想Ⅱ不成立.
[結論]石墨棒能使氧化銅還原成銅,該反應的化學方程式為________.
[改進]把石墨棒換成鋁粉,重復上述操作,又獲成功.那么,稱取等量的鋁粉并進行同樣的操作,其目的是________.改進后的實驗證明,金屬鋁與銅活動性順序是________,該反應的化學方程式為________.[拓展]如果使用復印機的“碳粉”代替石墨棒還原氧化銅,效果更好.聯想在空氣中灼熱的鐵絲不能燃燒,而鐵粉能燃燒,其原因是________.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學興趣小組對酸、堿、鹽的部分性質進行探究。
(探究一)氫氧化鈉與二氧化碳反應
甲同學設計實驗方案如圖1所示:

(1)圖1中的實驗現象為_____________,甲同學由此判斷氫氧化鈉和二氧化碳發生了反應。
(2)小組內其他同學認為甲同學方案不完善,理由是________________。并對實驗進行了改進,改進裝置如圖2所示:在A處放置適量干冰,B處裝入適量的濃NaOH溶液,量筒中加入足量的稀鹽酸,實驗過程中,觀察到量筒中有氣泡冒出,原因是______________。一段時間后,觀察到的現象是:①量筒中溶液倒吸入B中;②_________________,說明二氧化碳確實與氫氧化鈉發生了反應。
(探究二)氫氧化鈉和鹽酸發生中和反應時放出熱量
乙同學向一定量10﹪的氫氧化鈉溶液中滴加10﹪的鹽酸,滴加過程中溫度變化如下表:
加入鹽酸體積V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
混合溶液溫度T/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)反應的化學方程式為________________。
(4)根據表中數據分析混合溶液溫度變化的原因_______________。
(5)小組內其他同學提出“將10﹪的鹽酸直接滴入氫氧化鈉固體中也能得出相同結論”,你認為是否合理并說明理由_______________。
(6)丙同學將甲同學和乙同學實驗后的溶液混合,未發現明顯現象。現將混合液中的氯化鈉進行提純,具體的操作為____________。
(探究三)碳酸鈉溶液與稀鹽酸的分步反應
(查閱資料)向碳酸鈉溶液中逐滴加入稀鹽酸的反應是分步反應,第一步反應生成碳酸氫鈉和氯化鈉,當碳酸鈉反應完后才發生第二步反應。
丁同學向106g質量分數為10﹪的碳酸鈉溶液中逐滴加入質量分數為3.65﹪的稀鹽酸,生成二氧化碳的質量變化如圖3所示(不考慮CO2的溶解)。
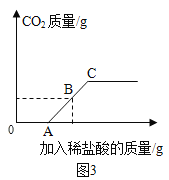
(7)A→Cspan>段發生反應的化學方程式為________________。
(8)若B點橫坐標為150,則其縱坐標為______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com