寫出下列物質的化學用語:
(1)亞鐵離子 ;(2)硫酸鋁 ;
(3)氨氣 ;(4)碳酸鈉 .
(5)化學反應在從古至今的生產中都起著非常重要的作用.請按要求寫出化學方程式:
①古代的濕法煉銅 ;
②工業上用赤鐵礦煉鐵 ;
③生石灰變成熟石灰 .
【答案】
分析:表示分子或原子團中原子個數的數字寫在元素符號的右下角.
表示離子所帶電荷數的數字寫在元素符號或離子符號的右上角,且數字在前(數字為“1”時省略),正負號在后.
書寫化學方程式時,必須熟悉反應物、生成物和反應條件,必須依據質量守恒定律的兩個原則.
解答:解:(1)1個亞鐵離子含有1個鐵原子且帶有2個單位的正電荷,因此1個亞鐵離子表示為Fe
2+.
(2)1個硫酸鋁分子含有2個鋁原子和3個硫酸根,1個硫酸根含有1個硫原子和4個氧原子,因此1個硫酸鋁分子表示為Al
2(SO
4)
3.
(3)1個氨氣分子含有1個氮原子和3個氫原子,因此1個氨分子表示為NH
3.
(4)1個碳酸鈉分子含有2個鈉原子和1個碳酸根,1個碳酸根含有1個碳原子和3個氧原子,因此1個碳酸鈉分子表示為Na
2CO
3.
(5)①古代濕法煉銅是用鐵與硫酸銅溶液反應生成硫酸亞鐵和銅.
該反應的化學方程式為:Fe+CuSO
4=FeSO
4+Cu.
②工業上用赤鐵礦煉鐵是用一氧化碳與氧化鐵在高溫條件下反應生成鐵和二氧化碳.
該反應的化學方程式為:3CO+Fe
2O
3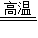
2Fe+3CO
2.
③生石灰變成熟石灰是用氧化鈣與水反應生成氫氧化鈣.
該反應的化學方程式為:CaO+H
2O=Ca(OH)
2.
故答案為:
(1)Fe
2+;(2)Al
2(SO
4)
3;(3)NH
3;(4)Na
2CO
3;
(5)①Fe+CuSO
4=FeSO
4+Cu;
②3CO+Fe
2O
3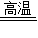
2Fe+3CO
2;
③CaO+H
2O=Ca(OH)
2.
點評:本題主要考查化學式和化學方程式的書寫,難度稍大.

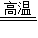 2Fe+3CO2.
2Fe+3CO2.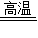 2Fe+3CO2;
2Fe+3CO2;

 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案