(2010?十堰)Na2SO3固體在空氣中易變質成Na2SO4,請計算在部分變質后的樣品中:
(1)所含鈉、硫元素的質量比為 ______.
(2)若含硫元素質量分數為a,則含氧元素的質量分數的計算式為 ______(用含a的代數式表示).
【答案】
分析:(1)對于這類題,就是尋找不變的定量關系,在此處無論是Na
2SO
3還是Na
2SO
4,硫元素和鈉元素質量比是不變的.樣品中中所含鈉、硫元素的質量比為:(鈉的相對原子質量×鈉原子個數):(硫的相對原子質量×硫原子個數);
(2)現在已知S元素的質量分數為a,根據鈉、硫元素的質量比可以計算出Na元素質量分數,1-Na元素質量分數-S元素的質量分數=氧元素的質量分數.
解答:解:(1)樣品中中所含鈉、硫元素的質量比為:(23×2):32=23:16;
(2)∵鈉、硫元素的質量比為23:16,硫元素質量分數為a,
∴Na元素的質量分數=
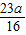
,
∴O元素的質量分數=1-a-
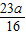
=1-

.
點評:本題主要是有關元素質量比的計算.解題的關鍵是分析化學式,找出不變的定量關系.

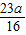 ,
,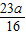 =1-
=1- .
.
