解:(1)由圖象可知,N點時所加的稀鹽酸已經過量,所以此時溶液呈酸性,pH小于7,所以溶液中的溶質是反應生成的氯化鈉和過量鹽酸中的氯化氫.
(2)設純堿樣品中碳酸鈉的質量為x,生成二氧化碳的質量為y,氯化鈉的質量z
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 73 117 44
x 73g×10% z y
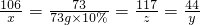
解得:x=10.6g,y=4.4g,z=11.7g
(3)當滴加了73g稀鹽酸時,溶液中溶質的質量分數為:

=25.7%.
(4)圖Ⅰ裝置組合來測定純堿的質量分數不完善,因為稀鹽酸也能揮發出氯化氫氣體,氯化氫氣體能被C裝置吸收導致測量的結果出現誤差;
故答案為:(1)NaCl、HCl;(2)4.4;(3)25.7%;(4)稀鹽酸會揮發出氯化氫氣體會被C裝置吸收;偏大;
分析:由圖象可知,消耗稀鹽酸73g時,樣品中的碳酸鈉和稀鹽酸恰好完全反應,此時溶液是氯化鈉溶液,呈中性,之后再加稀鹽酸溶液就會呈酸性;然后可根據碳酸鈉和稀鹽酸完全反應時消耗的鹽酸的量來計算反應的碳酸鈉、生成二氧化碳和氯化鈉的質量,由以上數據可計算出溶液中溶質的質量分數.裝置I的問題在于使用鹽酸反應時,由于鹽酸能揮發處氯化氫氣體,所以會導致測量的結果不夠準確,據此分析即可;
點評:本題主要考查學生對完全反應的認識和運用化學方程式進行計算的能力;解題的關鍵是依據圖象判斷反應的狀況.


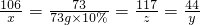
 =25.7%.
=25.7%.
