質量相同的鎂、鐵、鋅分別跟足量的鹽酸充分反應,生成氣體的質量由大到小的順序是( )
A.鎂、鐵、鋅
B.鐵、鎂、鋅
C.鋅、鐵、鎂
D.鎂、鋅、鐵
【答案】
分析:根據選項中元素的相對原子質量和它們與稀鹽酸反應的化學方程式,計算出1g這些金屬分別與足量稀鹽酸反應生成氫氣的質量,再進行比較即可
解答:解:根據化學方程式:Mg+2HCl═MgCl
2+H
2↑;Zn+2HCl═ZnCl
2+H
2↑;Fe+2HCl═FeCl
2+H
2↑
可以看出:Mg的相對原子質量為24,24g鎂可反應生成2g氫氣,即1g鎂生成
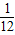
克氫氣.
Zn的相對原子質量為65,65g鋅可反應生成2g氫氣,即1g鋅生成
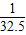
克氫氣.
鐵的相對原子質量56,56g鐵可反應生成2g氫氣,即1g鐵生成
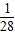
g氫氣.
因為
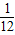
>
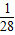
>

所以生成氣體的質量由大到小的順序是:鎂>鐵>鋅;
故選A.
點評:本題主要考查學生運用化學方程式綜合分析和解決實際問題的能力.增加了學生分析問題的思維跨度,強調了學生整合知識的能力;

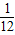 克氫氣.
克氫氣.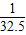 克氫氣.
克氫氣.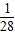 g氫氣.
g氫氣.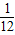 >
>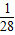 >
>


 閱讀快車系列答案
閱讀快車系列答案