
分析 (1)根據金屬活動性,黃銅(銅鋅合金)樣品中能和硫酸反應的只有鋅,銅不反應;
(2)(3)根據化學方程式中鋅的質量可求出參加反應的硫酸的質量,生成的硫酸鋅的質量,從而得出所用稀硫酸中溶質的質量分數;然后質量守恒定律求出所得溶液的總質量,進而求出溶液中溶質的質量分數.
解答 解:(1)黃銅(銅鋅合金)樣品中能和硫酸反應的只有鋅,銅不反應,所以鋅的質量=5.0g-3.7g=1.3g;
(2)(3)解:設稀硫酸中硫酸的質量分別為X、生成硫酸鋅的質量為Y,生成氫氣質量為z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
1.3g x y z
$\frac{65}{13.g}$=$\frac{98}{x}$,解得:x=1.96g $\frac{65}{1.3g}$=$\frac{161}{y}$解得:y=3.22g;
$\frac{65}{1.3g}$=$\frac{2}{z}$,解得:z=0.04g;
稀硫酸中硫酸的質量分數=$\frac{1.96g}{20.0g}$×100%=9.8%
所得溶液中硫酸鋅的質量分數=$\frac{3.22g}{20.0g+1.3g-0.04g}$×100%≈15.1%
答:稀硫酸中溶質的質量分數為9.8%;反應后所得溶液中硫酸鋅的質量分數為15.1%.
點評 本題重點考查金屬活動性順序的應用,并利用化學方程式進行計算物質的質量和溶液中溶質的質量分數,要求我們能正確分析題目信息和數據.


科目:初中化學 來源: 題型:選擇題
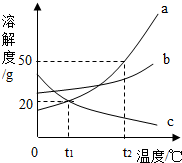 如圖是三種物質的溶解度曲線,下列說法正確的是( )
如圖是三種物質的溶解度曲線,下列說法正確的是( )| A. | 物質c的溶解度隨溫度的升高而增大 | |
| B. | 物質a的溶解度大于物質c的溶解度 | |
| C. | t2℃時,60g物質a與100g水充分混合后所得溶液的總質量為160g | |
| D. | 將t1℃b、c兩種物質的飽和溶液升溫至t2℃,溶液中溶質質量分數不變的是b溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 物質 | a | b | c | d |
| 反應前的質量/g | 6.4 | 14.0 | 3.2 | 1.0 |
| 反應一段時間后的質量/g | 10.0 | 7.2 | x | 1.0 |
| A. | a和b是反應物 | B. | x=3.2 | ||
| C. | 該反應屬于分解反應 | D. | d一定是催化劑 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com