
 金屬鎂將成為二十一世紀大有前途的綠色金屬材料.
金屬鎂將成為二十一世紀大有前途的綠色金屬材料.| 所加氫氧化鈉溶液的次數(shù) | 第一次 | 第二次 | 第三次 |
| 剩余固體的質(zhì)量/g | 10.6 | 5.2 | 4.0 |
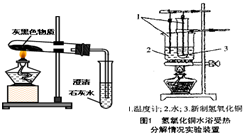
 2MgO+C;一種單質(zhì)和一種化合物反應(yīng)生成另一種單質(zhì)和另一種化合物,屬于置換反應(yīng);該實驗證明干冰在點燃條件下能與鎂反應(yīng)生成氧化鎂和碳,稀鹽酸或稀硫酸可以驗證上述反應(yīng)所得固體中有無剩余鎂,因為鎂能和稀鹽酸或稀硫酸反應(yīng)生成氫氣,如果有會產(chǎn)生氣泡;②根據(jù)正價在前,負價在后,十字交叉再約簡,所以化學(xué)式是:
2MgO+C;一種單質(zhì)和一種化合物反應(yīng)生成另一種單質(zhì)和另一種化合物,屬于置換反應(yīng);該實驗證明干冰在點燃條件下能與鎂反應(yīng)生成氧化鎂和碳,稀鹽酸或稀硫酸可以驗證上述反應(yīng)所得固體中有無剩余鎂,因為鎂能和稀鹽酸或稀硫酸反應(yīng)生成氫氣,如果有會產(chǎn)生氣泡;②根據(jù)正價在前,負價在后,十字交叉再約簡,所以化學(xué)式是: 2MgO+H2O+CO2↑;
2MgO+H2O+CO2↑;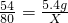 解得X=8g,所以所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分數(shù)為
解得X=8g,所以所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分數(shù)為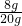 ×100%=40%.
×100%=40%. 2MgO+C;置換;在點燃條件下能與鎂反應(yīng);稀鹽酸;有氣泡產(chǎn)生;Mg3N2;(3)氧化鎂通常為白色固體;石灰水變渾濁的現(xiàn)象可說明此變化過程中有二氧化碳生成,而氫氧化鎂中根本不含碳元素;
2MgO+C;置換;在點燃條件下能與鎂反應(yīng);稀鹽酸;有氣泡產(chǎn)生;Mg3N2;(3)氧化鎂通常為白色固體;石灰水變渾濁的現(xiàn)象可說明此變化過程中有二氧化碳生成,而氫氧化鎂中根本不含碳元素; 2MgO+H2O+CO2↑;(4)1:3;40%.
2MgO+H2O+CO2↑;(4)1:3;40%.

 開心快樂假期作業(yè)暑假作業(yè)西安出版社系列答案
開心快樂假期作業(yè)暑假作業(yè)西安出版社系列答案科目:初中化學(xué) 來源: 題型:閱讀理解
| 步驟 | 實驗操作 | 實驗現(xiàn)象 | 結(jié)論 |
| 1 | 取少量樣品于試管中,加水完全溶解,再加入 過量氯化鋇溶液 過量氯化鋇溶液 |
生成白色沉淀 生成白色沉淀 |
丙的猜想不成立 |
| 2 | 取步驟1反應(yīng)后的溶液與試管中 滴加無色的酚酞試液 滴加無色的酚酞試液 |
無明顯現(xiàn)象 無明顯現(xiàn)象 |
只有甲的猜想成立 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:閱讀理解
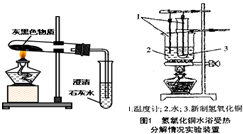 金屬鎂將成為二十一世紀大有前途的綠色金屬材料.
金屬鎂將成為二十一世紀大有前途的綠色金屬材料.
| ||
| ||
| ||
| ||
| 所加氫氧化鈉溶液的次數(shù) | 第一次 | 第二次 | 第三次 |
| 剩余固體的質(zhì)量/g | 10.6 | 5.2 | 4.0 |
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:閱讀理解
查看答案和解析>>
科目:初中化學(xué) 來源: 題型:閱讀理解
| ||
| ||
| 實驗步驟 | 實驗現(xiàn)象 | 實驗結(jié)論 |
| 取少量樣品于試管中,滴加 Ca(OH)2溶液 Ca(OH)2溶液 |
生成白色沉淀 生成白色沉淀 |
該氫氧化鈉溶液已變質(zhì) |
| 實驗步驟 | 實驗現(xiàn)象 | 實驗結(jié)論 |
| 取少量樣品于試管中,加入足量的 CaCl2 CaCl2 溶液,過濾,在濾液中滴加無色酚酞 無色酚酞 溶液 |
產(chǎn)生白色沉淀 溶液變紅 溶液變紅 |
該氫氧化鈉 部分 部分 變質(zhì)(填“部分”或“全部”) |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com