20.課本“分解過氧化氫制氧氣的反應中二氧化錳的催化作用”以及“尋找新的催化劑”
研究性實驗,引起了化學探究小組的興趣.
思考:判斷某物質是否為催化劑,不僅要看該物質是否改變了其它物質的化學反應速率,還要看其自身的質量和化學性質在反應前后有無發生變化.
經探究:除了MnO
2固體外,FeCl
3溶液和CuSO
4溶液均可對H
2O
2分解具有催化作用.下面是化學探究小組對這幾種催化劑進行的進一步的實驗探究.
一、探究“MnO
2的用量對 H
2O
2分解反應的影響”
利用圖甲裝置探究“MnO
2的用量對 H
2O
2分解反應的影響”,實驗中H
2O
2的溶質質量分數為3%,裝置中產生氧氣的量可以用壓強傳感器測出(在等溫條件下,產生氧氣體積與裝置內壓強成正比.反應放熱忽略不計.)
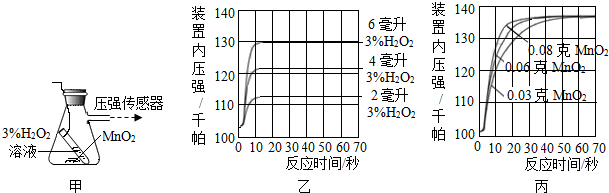
(1)寫出裝置中發生反應的符號表達式2H
2O
2$\frac{\underline{\;MnO_2\;}}{\;}$2H
2O+O
2↑.
(2)圖乙是“0.1克MnO
2與不同體積的3%H
2O
2溶液混合”的實驗結果,從圖中可以看出H
2O
2溶液的用量越多,產生的氧氣越多.
(3)當用“3%H
2O
2溶液8毫升與不同質量的MnO
2混合”時,得到如圖丙所示的曲線.曲線的斜率顯示,當MnO
2的用量增加到0.08克時,分解速度達到實驗要求.在此實驗條件下,若MnO
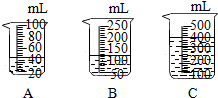
2的質量有4克(一藥匙),就能使如圖C(選填字母)燒杯中所裝的3%H
2O
2溶液,其分解速度最接近實驗要求.
二、探究相同濃度的FeCl
3溶液和CuSO
4溶液對H
2O
2分解的催化效果
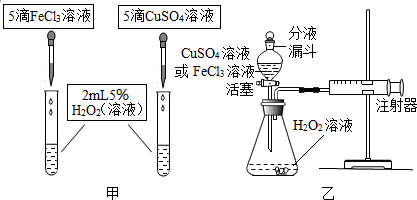
【定性研究】
(4)如圖甲,可通過觀察產生氣泡的速率來定性比較兩者的催化效果.
【定量研究】
(5)如圖乙,實驗前檢查該裝置氣密性的方法是先將分液漏斗的活塞關閉,然后用雙手緊握錐形瓶的外壁,然后觀察注射器的活塞是否向外移動,若向外移動,說明該裝置的氣密性是良好的.要定量比較兩者的催化效果,可測量生成等體積氣體所需的時間.
【實驗拓展】
探究小組同學通過查閱資料得知:除了上述幾種物質可以做過氧化氫溶液分解的催化劑外,CuO、馬鈴薯等也可以做過氧化氫溶液分解的催化劑.下列有關催化劑的說法中正確的是B(填序號).
A.不用催化劑過氧化氫溶液就不能分解
B.同一個化學反應可以有多種催化劑,同一物質也可以做不同反應的催化劑
C.催化劑只能加快化學反應的速率
D.某同學用氯酸鉀制氧氣時,誤將高錳酸鉀當作MnO
2一起加熱,結果發現反應 速率和氧氣的產量均增加了,故催化劑還可以增加生成物的質量.

 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案



