銅和鐵是生產、生活中廣泛使用的金屬.
(1)用鹽酸可以除去鐵銹(主要成分是氧化鐵),它的化學方程式是______.
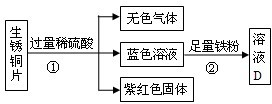
(2)有兩種銅合金(Ⅰ)Cu-Zn,(Ⅱ)Cu-Ag,將兩種銅合金分別放入稀硫酸溶液中,能夠與稀硫酸溶液發生的銅合金是______(填Ⅰ,Ⅱ),反應的化學方程式為______.
(3)將一嚴重銹蝕而部分變成銅綠[化學式為Cu2(OH)2CO3]的銅塊研磨成粉末,在空氣中充分灼燒,生成物為CuO,水和二氧化碳.反應的化學方程式為______.
(4)工業上用一氧化碳和磁鐵礦(主要成分是四氧化三鐵)冶煉生鐵,反應的化學方程式為______.冶煉2000t 含雜質3%的生鐵,需要90%的磁鐵礦的質量是______t.
解:(1)鹽酸與鐵銹的主要成分氧化鐵反應生成氯化鐵和水,化學方程式為:6HCl+Fe
2O
3=2FeCl
3+3H
2O
(2)鋅排在氫的前面,能與硫酸發生反應生成生成硫酸鋅和氫氣,化學方程式為:Zn+H
2SO
4═ZnSO
4+H
2↑,而銅和銀都在氫的后面,不能與酸反應,故選I.
(3)堿式碳酸銅在加熱的條件下生成氧化銅、二氧化碳和水,化學方程式為:Cu
2(OH)
2CO
3
2CuO+CO
2↑+H
2O↑
銅和氧氣在加熱條件下生成氧化銅,化學方程式為:2Cu+O
2
2CuO
(4)一氧化碳與四氧化三鐵在高溫條件下生成鐵和二氧化碳,化學方程式為:4CO+Fe
3O
4
3Fe+4CO
2 設磁鐵礦的質量為x
4CO+Fe
3O
4
3Fe+4CO
2 232 168
x×90% 2000t×3%
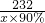
=
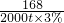
x=2977t
故答案為:(1)6HCl+Fe
2O
3=2FeCl
3+3H
2O
(2)I Zn+H
2SO
4═ZnSO
4+H
2↑
(3)Cu
2(OH)
2CO
3
2CuO+CO
2↑+H
2O↑ 2Cu+O
2
2CuO
(4)4CO+Fe
3O
4
3Fe+4CO
2 2977
分析:根據反應物、生成物、反應條件及書寫化學方程式的原則書寫化學方程式.氫前金屬能與酸反應,氫后金屬不能與酸反應;根據化學方程式,已知鐵的質量為2000t×3%,可以求出四氧化三鐵的質量,進而求出磁鐵礦的質量.
點評:本題考查化學方程式的書寫以及根據化學方程式的計算,明確化學方程式的書寫原則,會根據化學方程式進行簡單計算是解答本題關鍵.

 2CuO+CO2↑+H2O↑
2CuO+CO2↑+H2O↑ 2CuO
2CuO 3Fe+4CO2
3Fe+4CO2  3Fe+4CO2
3Fe+4CO2 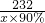 =
=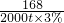
 2CuO+CO2↑+H2O↑ 2Cu+O2
2CuO+CO2↑+H2O↑ 2Cu+O2 2CuO
2CuO 3Fe+4CO2 2977
3Fe+4CO2 2977