
 (I)請結合下圖所示實驗裝置回答有關問題:
(I)請結合下圖所示實驗裝置回答有關問題:
| ||
| ||
| ||


 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:初中化學 來源: 題型:
 .
.查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
空氣中的SO2含量和可吸入顆粒的含量(可用g/cm3表示)都是重要的空氣質量指標。在工業生產上規定:空氣中二氧化硫的最大允許排放濃度不得超過0.02 mg/L。《2004年江蘇省環境狀況公報》指出:江蘇省2004年工業(主要是熱電廠)二氧化硫排放總量為1.24×106t,全省酸雨污染比較嚴重。分析降雨成分發現,雨水中陰離子仍以硫酸根離子為主,約占陰離子總量的61.9%。
(一)(1)正常的雨水顯 性(填:酸、堿、或中),原因是 ;
(2)由于大氣中SO2和NOx(NO和NO2)的含量不斷升高,并轉變為H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省這種酸雨形成過程有兩種途徑:一種是SO2在空氣中的飄塵做催化劑的作用下被氧氣氧化為SO3,溶于水生成硫酸,寫出有關的反應化學方程式 、 ;
另一種是SO2溶于水生成亞硫酸,再被空氣中的氧氣氧化成硫酸,寫出有關的反應化學方程式 、 。由于SO2的氧化非常緩慢,故后一種途徑是其主要形成過程。
(3)興趣小組同學取剛降到熱電廠附近的雨水進行測定,每隔五分鐘測一次pH,其數據如下表所示:
| 測定時刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述數據變化,你可以得出的結論是 ;針對此結論,你猜測其中的原因為 。結合大理石被酸雨腐蝕的事實,你認為碳酸、硫酸、亞硫酸酸性由強到弱的順序為__________________________。
(二)SO2氣體能使品紅溶液、高錳酸鉀溶液褪色。

回答以下問題:
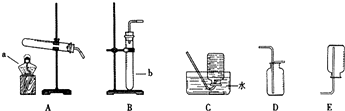
(1)單獨檢查裝置C的氣密性的操作是:關閉活塞b,然后________________________ ,
若發現________________,說明裝置C氣密性良好。
(2)實驗室用Na2SO3固體和硫酸溶液制取SO2氣體,應選用__________(選“A”或“C”)做氣體發生裝置,不選用另一裝置的理由是 。
(3)小組的同學在A、C裝置中的另一個用塊狀FeS固體和稀硫酸制取H2S氣體,反應的方程式為_________________ 。
(4)SO2氣體通過D裝置時現象是____________________ ,通過E裝置時現象是________________ ;SO2與H2S在B裝置中反應,生成一種氧化物和一種單質,反應的方程式是 。
(5)F儀器的名稱是___________;F中盛有NaOH固體,作用是
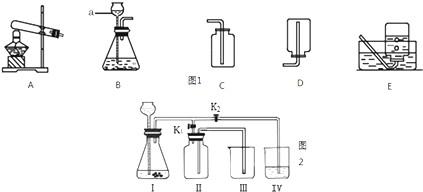
(三)⑴為測定某地方的空氣中SO2和可吸入顆粒的含量,查閱資料得知:可用含有一定量碘的溶液測定空氣中的SO2含量,反應方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同學設計了如下圖所示的實驗裝置:

①應用上述裝置測定空氣中的SO2含量和可吸入顆粒的含量,除測定氣體流速(單位:cm3/min)外,還需要測定吸收前后顆粒吸附劑、棉花、盛放容器的總質量和 。
②已知:碘單質微溶于水,KI可以增大碘在水中的溶解度。
請你協助甲同學完成稀碘溶液的配制:
第一步:準確稱取1.27g碘單質加入燒杯中, ;
第二步:加適量水使之完全溶解,然后加水至溶液體積為1000 mL;
第三步:從第二步所得溶液中,取出10.00mL溶液加入稀釋至100mL。
⑵乙同學擬用下列簡易裝置測定空氣中的SO2含量:準確取50mL第三步所得的碘溶液,注入右圖所示廣口瓶中,加2~3滴淀粉指示劑,此時溶液呈藍色。在指定的測定地點抽氣,每次抽氣100mL,直到溶液的藍色全部褪盡為止,記錄抽氣次數(n)。
假設乙同學的測量是準確的,乙同學抽氣的次數為80次,計算說明該地空氣中的SO2含量是否符合排放標準。(寫出解題過程,此題3分)

⑶該小組同學認為這些工廠要對排出的廢氣進行處理,為了達到最好效果,在實驗室進行了實驗模擬,你認為他們為了吸收產生的SO2氣體,所使用藥品應該是________,發生的化學反應方程式______________________________________
經過再三思考,設計了以下裝置,認為下列哪種不能采用______,因為其他裝置都具有________作用。

A B C D E F G H I J
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
空氣中的SO2含量和可吸入顆粒的含量(可用g/cm3表示)都是重要的空氣質量指標。在工業生產上規定:空氣中二氧化硫的最大允許排放濃度不得超過0.02 mg/L。《2004年江蘇省環境狀況公報》指出:江蘇省2004年工業(主要是熱電廠)二氧化硫排放總量為1.24×106t,全省酸雨污染比較嚴重。分析降雨成分發現,雨水中陰離子仍以硫酸根離子為主,約占陰離子總量的61.9%。
(一)(1)正常的雨水顯 性(填:酸、堿、或中),原因是 ;
(2)由于大氣中SO2和NOx(NO和NO2)的含量不斷升高,并轉變為H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省這種酸雨形成過程有兩種途徑:一種是SO2在空氣中的飄塵做催化劑的作用下被氧氣氧化為SO3,溶于水生成硫酸,寫出有關的反應化學方程式 、 ;
另一種是SO2溶于水生成亞硫酸,再被空氣中的氧氣氧化成硫酸,寫出有關的反應化學方程式 、 。由于SO2的氧化非常緩慢,故后一種途徑是其主要形成過程。
(3)興趣小組同學取剛降到熱電廠附近的雨水進行測定,每隔五分鐘測一次pH,其數據如下表所示:
| 測定時刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述數據變化,你可以得出的結論是 ;針對此結論,你猜測其中的原因為 。結合大理石被酸雨腐蝕的事實,你認為碳酸、硫酸、亞硫酸酸性由強到弱的順序為__________________________。
(二)SO2氣體能使品紅溶液、高錳酸鉀溶液褪色。

回答以下問題:
(1)單獨檢查裝置C的氣密性的操作是:關閉活塞b,然后________________________ ,
若發現________________,說明裝置C氣密性良好。
(2)實驗室用Na2SO3固體和硫酸溶液制取SO2氣體,應選用__________(選“A”或“C”)做氣體發生裝置,不選用另一裝置的理由是 。
(3)小組的同學在A、C裝置中的另一個用塊狀FeS固體和稀硫酸制取H2S氣體,反應的方程式為_________________ 。
(4)SO2氣體通過D裝置時現象是____________________ ,通過E裝置時現象是________________ ;SO2與H2S在B裝置中反應,生成一種氧化物和一種單質,反應的方程式是 。
(5)F儀器的名稱是___________;F中盛有NaOH固體,作用是
(三)⑴為測定某地方的空氣中SO2和可吸入顆粒的含量,查閱資料得知:可用含有一定量碘的溶液測定空氣中的SO2含量,反應方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同學設計了如下圖所示的實驗裝置:

①應用上述裝置測定空氣中的SO2含量和可吸入顆粒的含量,除測定氣體流速(單位:cm3/min)外,還需要測定吸收前后顆粒吸附劑、棉花、盛放容器的總質量和 。
②已知:碘單質微溶于水,KI可以增大碘在水中的溶解度。
請你協助甲同學完成稀碘溶液的配制:
第一步:準確稱取1.27g碘單質加入燒杯中, ;
第二步:加適量水使之完全溶解,然后加水至溶液體積為1000 mL;
第三步:從第二步所得溶液中,取出10.00mL溶液加入稀釋至100mL。
⑵乙同學擬用下列簡易裝置測定空氣中的SO2含量:準確取50mL第三步所得的碘溶液,注入右圖所示廣口瓶中,加2~3滴淀粉指示劑,此時溶液呈藍色。在指定的測定地點抽氣,每次抽氣100mL,直到溶液的藍色全部褪盡為止,記錄抽氣次數(n)。
假設乙同學的測量是準確的,乙同學抽氣的次數為80次,計算說明該地空氣中的SO2含量是否符合排放標準。(寫出解題過程,此題3分)

⑶該小組同學認為這些工廠要對排出的廢氣進行處理,為了達到最好效果,在實驗室進行了實驗模擬,你認為他們為了吸收產生的SO2氣體,所使用藥品應該是________,發生的化學反應方程式______________________________________
經過再三思考,設計了以下裝置,認為下列哪種不能采用______,因為其他裝置都具有________作用。

A B C D E F G H I J
查看答案和解析>>
科目:初中化學 來源:2011-2012學年云南省蒙自市博通總校初三化學綜合復習化學試卷 題型:探究題
空氣中的SO2含量和可吸入顆粒的含量(可用g/cm3表示)都是重要的空氣質量指標。在工業生產上規定:空氣中二氧化硫的最大允許排放濃度不得超過0.02 mg/L。《2004年江蘇省環境狀況公報》指出:江蘇省2004年工業(主要是熱電廠)二氧化硫排放總量為1.24×106t,全省酸雨污染比較嚴重。分析降雨成分發現,雨水中陰離子仍以硫酸根離子為主,約占陰離子總量的61.9%。
(一)(1)正常的雨水顯 性(填:酸、堿、或中),原因是 ;
(2)由于大氣中SO2和NOx(NO和NO2)的含量不斷升高,并轉變為H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省這種酸雨形成過程有兩種途徑:一種是SO2在空氣中的飄塵做催化劑的作用下被氧氣氧化為SO3,溶于水生成硫酸,寫出有關的反應化學方程式 、 ;
另一種是SO2溶于水生成亞硫酸,再被空氣中的氧氣氧化成硫酸,寫出有關的反應化學方程式 、 。由于SO2的氧化非常緩慢,故后一種途徑是其主要形成過程。
(3)興趣小組同學取剛降到熱電廠附近的雨水進行測定,每隔五分鐘測一次pH,其數據如下表所示:
|
測定時刻 |
5∶05 |
5∶10 |
5∶15 |
5∶20 |
5∶25 |
5∶30 |
5∶35 |
|
pH |
4.95 |
4.94 |
4.94 |
4.88 |
4.86 |
4.85 |
4.85 |
分析上述數據變化,你可以得出的結論是 ;針對此結論,你猜測其中的原因為 。結合大理石被酸雨腐蝕的事實,你認為碳酸、硫酸、亞硫酸酸性由強到弱的順序為__________________________。
(二)SO2 氣體能使品紅溶液、高錳酸鉀溶液褪色。

回答以下問題:
(1)單獨檢查裝置C的氣密性的操作是:關閉活塞b,然后________________________ ,
若發現________________,說明裝置C氣密性良好。
(2)實驗室用Na2SO3固體和硫酸溶液制取SO2氣體,應選用__________(選“A”或“C”)做氣體發生裝置,不選用另一裝置的理由是 。
(3)小組的同學在A、C裝置中的另一個用塊狀FeS固體和稀硫酸制取H2S氣體,反應的方程式為_________________ 。
(4)SO2氣體通過D裝置時現象是____________________ ,通過E裝置時現象是________________ ;SO2與H2S在B裝置中反應,生成一種氧化物和一種單質,反應的方程式是 。
(5)F儀器的名稱是___________;F中盛有NaOH固體,作用是
(三)⑴為測定某地方的空氣中SO2和可吸入顆粒的含量,查閱資料得知:可用含有一定量碘的溶液測定空氣中的SO2含量,反應方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同學設計了如下圖所示的實驗裝置:
①應用上述裝置測定空氣中的SO2含量和可吸入顆粒的含量,除測定氣體流速(單位:cm3/min)外,還需要測定吸收前后顆粒吸附劑、棉花、盛放容器的總質量和 。
②已知:碘單質微溶于水,KI可以增大碘在水中的溶解度。
請你協助甲同學完成稀碘溶液的配制:
第一步:準確稱取1.27g碘單質加入燒杯中, ;
第二步:加適量水使之完全溶解,然后加水至溶液體積為1000 mL;
第三步:從第二步所得溶液中,取出10.00mL溶液加入稀釋至100 mL。
⑵乙同學擬用下列簡易裝置測定空氣中的SO2含量:準確取50mL第三步所得的碘溶液,注入右圖所示廣口瓶中,加2~3滴淀粉指示劑,此時溶液呈藍色。在指定的測定地點抽氣,每次抽氣100mL,直到溶液的藍色全部褪盡為止,記錄抽氣次數(n)。
假設乙同學的測量是準確的,乙同學抽氣的次數為80次,計算說明該地空氣中的SO2含量是否符合排放標準。(寫出解題過程,此題3分)

⑶該小組同學認為這些工廠要對排出的廢氣進行處理,為了達到最好效果,在實驗室進行了實驗模擬,你認為他們為了吸收產生的SO2 氣體,所使用藥品應該是________,發生的化學反應方程式______________________________________
經過再三思考,設計了以下裝置,認為下列哪種不能采用______,因為其他裝置都具有________作用。

A B C D E F G H I J
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com