
 如圖所示的照片拍攝于某處天然溫泉,請回答下列問題:
如圖所示的照片拍攝于某處天然溫泉,請回答下列問題:| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 4.9 | 9.1 | 19.5 | 40.8 | 48.8 | 47.6 | 45.3 | 45 | 43.7 | 42.7 |
分析 (1)根據硫酸鈉的溶解度隨溫度的變化情況來分析;
(2)根據硬水與軟水的概念來分析;
(3)根據硫酸鈉在不同溫度的溶解度以及其溶解度受溫度的影響來分析;
(4)根據化學反應的原理以及化學方程式的寫法來分析.
解答 解:(1)由表格數據可知,0℃-40℃時,硫酸鈉的溶解度隨著溫度的升高而增大,但是40℃后隨著溫度的升高,硫酸鈉的溶解度反而減小,所以對這種物質只能采用蒸發結晶的方法來提取;故填:蒸發結晶;
(2)溫泉水中含有較多的可溶性鈣離子、和鎂離子,所以該溫泉水屬于硬水;故填:硬水;
(3)A.10℃時,硫酸鈉的溶解度為9.1g,所以10℃時,在100g水中加入47g Na2SO4固體只能溶解9.1g,所以所得溶液中溶質的質量分數為$\frac{9.1g}{9.1g+100g}×100%$≈8.3%,故正確;
B.10℃時,硫酸鈉的溶解度為9.1g;60℃時,硫酸鈉的溶解度為45.3g,所以在100g水中所溶解的硫酸鈉的質量不同,因此溶質的質量分數也不相同,故錯誤;
C.由溶解度數據可知,40℃和50℃時,硫酸鈉的溶解度均大于47g,而60℃時,硫酸鈉的溶解度減小為45.3g,所以加熱過程中,40℃和50℃時溶質的質量分數相同,溶液中溶質的質量分數最大,故錯誤;
D.加熱過程中,溶液中溶劑的質量始終不變,仍為100g,故正確;
E.10℃升至60℃,Na2SO4的溶解度先變大,后變小,故錯誤;
F.由表格數據可知,0℃-40℃時,硫酸鈉的溶解度隨著溫度的升高而增大,但是40℃后隨著溫度的升高,硫酸鈉的溶解度反而減小,小到47g以下,因此加熱過程中,Na2SO4溶液由飽和溶液變成不飽和溶液,最終又變成飽和溶液,故正確;
故填:A、D、F;
(4)硫酸鈉與氯化鋇發生復分解反應生成硫酸鋇白色沉淀和氯化鈉,故填:Na2SO4+BaCl2=BaSO4↓+2NaCl.
點評 本題考查了結晶方法、硬水與軟水的判斷、溶解度等的有關知識,完成此題,可以依據已有的知識結合題干提供的信息進行.


 優學名師名題系列答案
優學名師名題系列答案科目:初中化學 來源: 題型:解答題
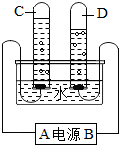 人類的日常生活和工農業生產都離不開水.請回答下列與水有關的問題:
人類的日常生活和工農業生產都離不開水.請回答下列與水有關的問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物質 | 雜質 | 除雜質的方法 |
| A | K2CO3溶液 | KCl | 加入適量的稀鹽酸 |
| B | Fe | Zn | 加入足量的FeSO4溶液,充分反應,過濾,烘干 |
| C | NaOH溶液 | Na2CO3 | 加入足量的BaCl2溶液,充分反應,過濾 |
| D | H2 | HCl | 將氣體通過盛濃硫酸的洗氣瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題


查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
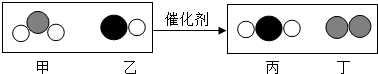
| A. | 乙物質由兩個元素組成. | |
| B. | 甲和丁中同種元素化合價不相等 | |
| C. | 該反應中涉及到的最小微粒是分子 | |
| D. | 化學方程式中乙、丁的物質的量之比為1:1 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 如圖是電解水的微觀模型圖,從中獲得的信息不正確的是( )
如圖是電解水的微觀模型圖,從中獲得的信息不正確的是( )| A. | 在化學反應中,分子可以再分,原子不能再分 | |
| B. | 每個水分子由2個氫原子和1個氧原子構成 | |
| C. | 水分解過程中,原子的種類、分子的種類都不變 | |
| D. | 在化學反應中,元素的種類和質量都不改變 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
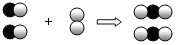 如圖是用來表示物質間發生化學變化的模型示意圖,圖中“
如圖是用來表示物質間發生化學變化的模型示意圖,圖中“ 、
、 ”分別表示兩種不同元素的原子,能用該示意圖表示的化學反應是( )
”分別表示兩種不同元素的原子,能用該示意圖表示的化學反應是( )| A. | 2H2+O2$\frac{\underline{\;點燃\;}}{\;}$2H2O | B. | CH4+2O2$\frac{\underline{\;點燃\;}}{\;}$CO2+2H2O | ||
| C. | 2CO+O2 $\frac{\underline{\;點燃\;}}{\;}$2CO2 | D. | 2Na+Cl2$\frac{\underline{\;點燃\;}}{\;}$2NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com