

分析 (1)根據氧化鐵與鹽酸反應生成氯化鐵和水解答;氯化鐵和氫氧化鈉反應生成氫氧化鐵沉淀和氯化鈉解答;
(2)根據氫氧化鈉的質量求出氯化鐵的質量,從而求出氧化鐵的質量;
(3)根據氯化鐵和氫氧化鈉反應生成氫氧化鐵沉淀和氯化鈉解答;
(4)根據反應原理分析解答;
(5)根據第二次反應的氧化鐵的質量,計算出生成的氯化鐵的質量,根據溶質的質量分數計算公式即可解得;
(6)根據溶質質量一定,利用溶質質量分數公式進行計算即可.
(7)根據鐵元素質量相等列出等量關系,
解答 解:
(1)赤鐵礦的主要成分是氧化鐵,氧化鐵與鹽酸反應生成氯化鐵和水,反應的化學方程式為:Fe2O3 +6HCl=2FeCl3+3H2O;
氯化鐵和氰化鈉反應生成氫氧化鐵沉淀和氯化鈉,反應的化學方程式為:3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(2)設該赤鐵礦石中氧化鐵的質量為x
由Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.可知:
Fe2O3 ~6NaOH
160 240
x 200g×12%
$\frac{160}{x}=\frac{240}{200g×12%}$
x=16g
該赤鐵礦石中氧化鐵的純度為$\frac{16g}{20g}×$100%=80%;
(3)設實驗生成沉淀物質的質量為x,生成氯化鈉的質量為y
氫氧化鈉的質量為200g×12%=24g
3NaOH+FeCl3═Fe(OH)3↓+3NaCl
120 107 175.5
24g x y
$\frac{120}{24g}=\frac{107}{x}$
x=21.4g
$\frac{120}{24g}=\frac{175.5}{y}$
y=35.1g
(4)由3NaOH+FeCl3═Fe(OH)3↓+3NaCl
120 107
可知:每加入120份質量的氫氧化鈉,生成沉淀107份,溶液增加13份;故在滴加氫氧化鈉溶液的過程中,燒杯中溶質質量的變化情況為質量增加;
(5)若將反應后的濾液蒸發掉43.6g水,則所得不飽和溶液中溶質的質量分數為$\frac{35.1g}{16g+200g+200g-21.4g-43.6g}×$100%=10%;
(6)由Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
可知:HCl~NaOH 設HC的質量為z
36.5 40
z 24g
$\frac{36.5}{z}=\frac{40}{24g}$
z=21.9g
用溶質質量分數為36.5%的濃鹽酸為:$\frac{21.9g}{36.5%}$=60g
加入水的質量為:200g-60g=140g
需要濃鹽酸和水的質量最簡比為60g:140g=3:7;
(7)560t這樣的鐵礦石中鐵的質量=560t×80%=448t
菱鐵礦石的質量=448t$÷\frac{56}{116}×$100%÷(1-30%)≈1325.7t
答案:
(1)Fe2O3 +6HCl=2FeCl3+3H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
(2)80%;
(3)$\frac{120}{24g}=\frac{107}{x}$;
(4)質量增加;
(5)10%;
(6)3:7;
(7)1325.7t
點評 本題主要考查學生運用假設法和化學方程式進行計算和推斷的能力,同時考查了分析數據的能力,計算時要注意規范性和準確性.


科目:初中化學 來源: 題型:解答題
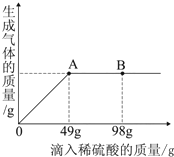 在一燒杯中盛有Na2CO3和Na2SO4組成的固體混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐漸滴加溶質質量分數為20%的稀硫酸.生成氣體的總質量與所滴入稀硫酸的質量關系曲線如圖所示,請根據題意回答問題:
在一燒杯中盛有Na2CO3和Na2SO4組成的固體混合物,加入134克水使Na2CO3和Na2SO4全部溶解,向其中逐漸滴加溶質質量分數為20%的稀硫酸.生成氣體的總質量與所滴入稀硫酸的質量關系曲線如圖所示,請根據題意回答問題:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
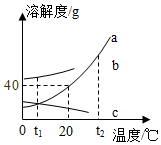 溶液在生產和生活中有著重要意義.如圖a、b、c三種固體物質的溶解度曲線請回答下列相關問題:
溶液在生產和生活中有著重要意義.如圖a、b、c三種固體物質的溶解度曲線請回答下列相關問題:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
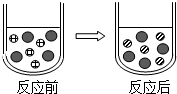 組成相似的鹽具有一些相似的化學性質.
組成相似的鹽具有一些相似的化學性質. Fe2+、
Fe2+、 S${{O}_{4}}^{2-}$、
S${{O}_{4}}^{2-}$、 Mg2+.
Mg2+.查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
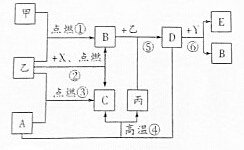 如圖所示是初中化學中常見物質間的轉化關系(部分生成物已略去),其中甲、乙為氣態單質,丙是目前應用最廣泛的金屬,A、B、C、D均為氧化物,常溫下B為液態,化合物E的水溶液呈黃色.
如圖所示是初中化學中常見物質間的轉化關系(部分生成物已略去),其中甲、乙為氣態單質,丙是目前應用最廣泛的金屬,A、B、C、D均為氧化物,常溫下B為液態,化合物E的水溶液呈黃色.查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 生鐵和鋼的性能完全相同 | B. | 煉鐵過程只發生物理變化 | ||
| C. | 常溫下所有金屬均為固態 | D. | 鐵在潮濕的空氣中易生銹 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 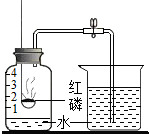 燒杯中的水進入集氣瓶至刻度1處,說明氮氣不易溶于水 燒杯中的水進入集氣瓶至刻度1處,說明氮氣不易溶于水 | |
| B. |  干燥的用石蕊染成紫色的紙花不變色,說明二氧化碳不顯酸性 干燥的用石蕊染成紫色的紙花不變色,說明二氧化碳不顯酸性 | |
| C. |  黃銅片與銅片相互刻畫,銅片上有劃痕,說明合金的硬度比純金屬大 黃銅片與銅片相互刻畫,銅片上有劃痕,說明合金的硬度比純金屬大 | |
| D. |  反應后稱得物質的質量減小,說明該反應不遵守質量守恒定律 反應后稱得物質的質量減小,說明該反應不遵守質量守恒定律 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com