解:(1)分液漏斗方便加液體藥品,也可以控制反應的速度,如果用雙氧水和二氧化錳制氧氣就不需要加熱,雙氧水在常溫下不易分解,其中二氧化錳起催化作用,實驗前,首先要檢查裝置的氣密性,故答案為:①分液漏斗;②H
2O
2;③A;催化;④檢查裝置的氣密性;
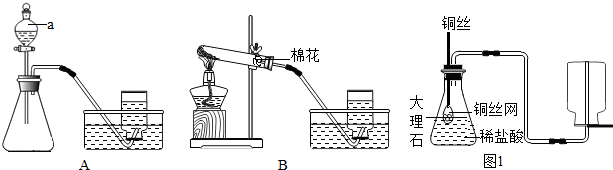
(2)高錳酸鉀受熱分解生成錳酸鉀和二氧化錳和氧氣,要注意配平;補充猜想Ⅲ:MnO
2和K
2MnO
4都放出氧氣,因為MnO
2和K
2MnO
4都含有氧元素;在250℃條件下加熱一段時間,冷卻后測得MnO
2的質量不變,則猜想Ⅰ是錯誤的;在試管口放一個帶火星的木條,觀察到木條復燃,說明有氧氣生成;設計的實驗方案是:取等量的錳酸鉀固體于兩支試管中,一支試管中加入氧化鉀,一支試管中不加入氧化鉀.用同樣火焰的酒精燈加熱,用相同規格的集氣瓶,用排水法收集一瓶氣體,收集一瓶氧氣所用的時間作比較,確定錳酸鉀的分解是否與氧化鉀有關系.故答案為:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;MnO
2和K
2MnO
4都放出氧氣;MnO
2和K
2MnO
4都含有氧元素;①Ⅰ;②在試管口放一個帶火星的木條,觀察到木條復燃;取等量的錳酸鉀固體于兩支試管中,一支試管中加入氧化鉀,一支試管中不加入氧化鉀.用同樣火焰的酒精燈加熱,用相同規格的集氣瓶,用排水法收集一瓶氣體,收集一瓶氧氣所用的時間作比較,確定錳酸鉀的分解是否與氧化鉀有關系.
(3)碳酸鈣和鹽酸互相交換成分生成氯化鈣和水和二氧化碳,配平即可;丙同學設計了實驗室制取CO
2裝置,出現了一個錯誤,糾正方法是把排水法改為向上排空氣法;此裝置的優點是:可以控制反應的速度;故答案為:①把排水法改為向上排空氣法;②CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;③可以控制反應的速度;
分析:分液漏斗方便加液體藥品,也可以控制反應的速度;實驗前,首先要檢查裝置的氣密性,制取裝置包括加熱和不需加熱兩種,如果用雙氧水制氧氣就不需要加熱,如果用高錳酸鉀或氯酸鉀制氧氣就需要加熱.氧氣的密度比空氣的密度大,不易溶于水,因此能用向上排空氣法和排水法收集.實驗室制取CO
2,是在常溫下,用碳酸鈣和鹽酸互相交換成分生成氯化鈣和水和二氧化碳,因此不需要加熱.二氧化碳能溶于水,密度比空氣的密度大,因此只能用向上排空氣法收集.設計的實驗方案是:取等量的錳酸鉀固體于兩支試管中,一支試管中加入氧化鉀,一支試管中不加入氧化鉀.用同樣火焰的酒精燈加熱,用相同規格的集氣瓶,用排水法收集一瓶氣體,收集一瓶氧氣所用的時間作比較,確定錳酸鉀的分解是否與氧化鉀有關系.氧氣的檢驗方法是:將帶火星的木條伸入試管口內,木條復燃,證明試管中收集的氣體是氧氣.丙同學設計了實驗室制取CO
2裝置,出現了一個錯誤,糾正方法是把排水法改為向上排空氣法;此裝置的優點是:可以控制反應的速度.
點評:本考點主要考查了儀器的名稱、氣體的制取裝置和收集裝置的選擇,同時也考查了化學方程式的書寫和實驗方案的設計等,綜合性比較強.氣體的制取裝置的選擇與反應物的狀態和反應的條件有關;氣體的收集裝置的選擇與氣體的密度和溶解性有關.本考點是中考的重要考點之一,主要出現在實驗題中.


 K2MnO4+MnO2+O2↑;MnO2和K2MnO4都放出氧氣;MnO2和K2MnO4都含有氧元素;①Ⅰ;②在試管口放一個帶火星的木條,觀察到木條復燃;取等量的錳酸鉀固體于兩支試管中,一支試管中加入氧化鉀,一支試管中不加入氧化鉀.用同樣火焰的酒精燈加熱,用相同規格的集氣瓶,用排水法收集一瓶氣體,收集一瓶氧氣所用的時間作比較,確定錳酸鉀的分解是否與氧化鉀有關系.
K2MnO4+MnO2+O2↑;MnO2和K2MnO4都放出氧氣;MnO2和K2MnO4都含有氧元素;①Ⅰ;②在試管口放一個帶火星的木條,觀察到木條復燃;取等量的錳酸鉀固體于兩支試管中,一支試管中加入氧化鉀,一支試管中不加入氧化鉀.用同樣火焰的酒精燈加熱,用相同規格的集氣瓶,用排水法收集一瓶氣體,收集一瓶氧氣所用的時間作比較,確定錳酸鉀的分解是否與氧化鉀有關系.

 閱讀快車系列答案
閱讀快車系列答案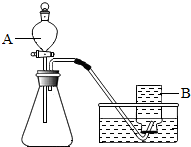 某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗.
某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗. 某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗.
某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗.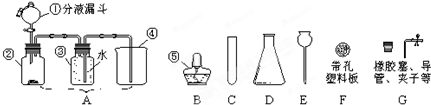
 某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗.
某興趣小組根據實驗室提供的儀器和藥品進行了氧氣的制備實驗.