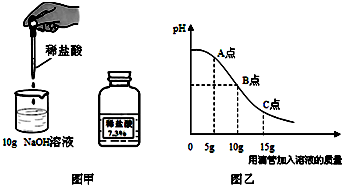
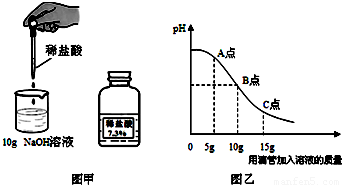
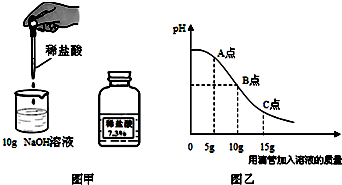
解:(1)氫氧化鈉溶液呈堿性,可使酚酞試液變紅,而中性溶液不能使酚酞變色,所以可以觀察到溶液由紅色變為無色;
(2)從圖中分析可以知道在A點時溶液仍呈堿性,所以此時加入酚酞試液,會變紅,而此時溶液中溶質為氫氧化鈉、和氯化鈉;
(3)檢驗鹽酸可以加入鐵粉,或是碳酸鈉粉末,若選擇Fe粉.若溶液中含有HCl,則Fe粉能和HCl反應產生氣泡.若選擇Na
2CO
3粉末.若溶液中含有HCl,則Na
2CO
3粉末能和HCl反應產生氣泡;
(4)根據題中信息可以知道恰好完全反應時所得溶液中溶質為氯化鈉,此時消耗鹽酸中氯化氫的質量為:10g×7.3%=0.73g;
設生成氯化鈉的質量為x
HCl+NaOH═NaCl+H
2O
36.5 58.5
0.73g x
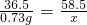
解得:x=1.17g
所以反應溶液中溶質的質量分數為:
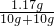
×100%=5.85%;
答:恰好完全反應時所得溶液中溶質的質量分數為5.85%.
故答案為:(1)溶液由紅色逐漸褪至無色;
(2)NaCl、NaOH;
(3)選擇Fe粉.若溶液中含有HCl,則Fe粉能和HCl反應產生氣泡.選擇Na
2CO
3粉末.若溶液中含有HCl,則Na
2CO
3粉末能和HCl反應產生氣泡.
(4)5.85%.
分析:(1)氫氧化鈉溶液呈堿性,可使酚酞試液變紅,而中性溶液不能使酚酞變色,可以據此解答;
(2)從圖中分析可以知道在A點時溶液仍呈堿性,所以此時加入酚酞試液,會變紅,而此時溶液中含有氫氧化鈉、和氯化鈉,可以據此解答該題;
(3)檢驗鹽酸可以加入鐵粉,或是碳酸鈉粉末,可以據此解答該題;
(4)從圖中分析可以知道10g鹽酸與氫氧化鈉溶液恰好完全反應,所以反應后的溶液為氯化鈉的溶液,所以可以據此結合化學方程式完成解答
點評:本題主要考查中和反應和學生運用化學方程式和溶質質量分數公式進行計算的能力.解題時要注意解題步驟的規范性.

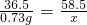
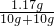 ×100%=5.85%;
×100%=5.85%;