
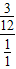 =1:4,根據前面計算的碳原子個數是4可推出氫原子個數是16,又因為已經有了14個氫原子個數,所以水需要提供2個氫原子個數就行,所以水分子個數只能是1;所以甲醇、乙醇、水的質量比就是2個甲醇分子和1個乙醇分子和1個水分子的質量比即:2×(12+1×3+16+1):12×2+1×5+16+1:1×2+16=64:46:18=32:23:9.
=1:4,根據前面計算的碳原子個數是4可推出氫原子個數是16,又因為已經有了14個氫原子個數,所以水需要提供2個氫原子個數就行,所以水分子個數只能是1;所以甲醇、乙醇、水的質量比就是2個甲醇分子和1個乙醇分子和1個水分子的質量比即:2×(12+1×3+16+1):12×2+1×5+16+1:1×2+16=64:46:18=32:23:9.

 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:
已知CH3OH、 C2H5OH、 H2O的混合物中,C、H、O的質量比為3:1:4,若甲醇與乙醇充
分燃燒所消耗的氧氣量相等,求混合物中甲醇、乙醇、水的質比為__________________.
 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com