
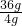 =9g,故加入6g NaCl晶體,得到的乙溶液為飽和溶液,據此分析解答即可.
=9g,故加入6g NaCl晶體,得到的乙溶液為飽和溶液,據此分析解答即可. ×100%≈16.7%;取30g甲溶液,依據溶液的均一性可知該溶液(120g溶液中的溶質是20g)中的溶質為5g,則溶劑的量是25g,依據該溫度下的溶解度可知,25g溶劑中最多能溶解的氯化鈉的質量是
×100%≈16.7%;取30g甲溶液,依據溶液的均一性可知該溶液(120g溶液中的溶質是20g)中的溶質為5g,則溶劑的量是25g,依據該溫度下的溶解度可知,25g溶劑中最多能溶解的氯化鈉的質量是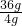 =9g,故加入6g NaCl晶體,得到的乙溶液為飽和溶液,故乙溶液的溶質質量分數為
=9g,故加入6g NaCl晶體,得到的乙溶液為飽和溶液,故乙溶液的溶質質量分數為 ×100%≈26.5%;
×100%≈26.5%;

科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com