
(15分) 某制堿廠以海水為主要原料生產純堿(碳酸鈉)和其他副產品。
(一)將海水進行處理后獲得精鹽水。海水中,除氯化鈉外,還含有氯化鎂、氯化鈣、硫酸鈉等雜質。其處理的主要流程如下:
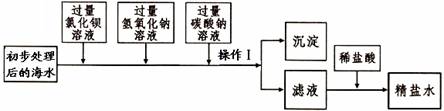
(1)加入氫氧化鈉溶液的目的是 。
(2)操作Ⅰ的名稱是 。
(3)操作1所得的沉淀是混合物,其成分有:BaSO4、Mg(OH)2、 (填化學式)。
(4)向濾液中滴加適量稀鹽酸的目的是 。
(二)將精鹽水制成飽和溶液,先向其中通入足量的氨氣,再向其中通入足量的二氧化碳至有大量晶體(碳酸氫鈉,NaHCO3)析出,反應的化學方程式為NaCl +NH3+CO2+H2O=NH4Cl+NaHCO3↓;將晶體轉移出來后,加熱至不再有氣體產生,所得固體即為純堿。
(1)加熱晶體碳酸氫鈉獲得純堿的化學方程式為 。
(2)稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化;另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀,根據上述實驗可確定純堿樣品含有雜質 (寫化學式)。
(三)為測定上述方法獲得的純堿產品中碳酸鈉的純度。某研究性學習小組對純堿產品進行檢測。取22克該樣品于燒杯中,加水將其溶解,然后逐滴加入溶質質量分數為14.6%的稀鹽酸并不斷振蕩。通過查閱資料得知,在滴加鹽酸過程中首先發生的反應是:Na2CO3+HCl=NaHCO3+NaCl;然后發生的反應是:NaHCO3+HCl= NaCl+H2O+CO2↑.,在上述過程中燒杯中溶液質量與加入稀鹽酸質量的關系如圖甲所示:.
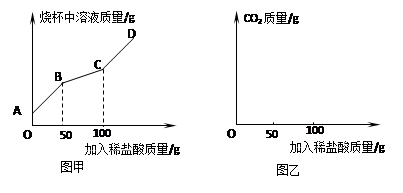
(1)某同學認為,在上述純堿含量測定過程中,用玻璃棒不斷攪拌,能使測定誤差減小,其理由是 。
(2)請你根據圖甲提供的信息,在圖乙的坐標系中畫出檢測過程中產生CO2的質量隨滴加鹽酸質量的變化曲線。(標明二氧化碳質量的相應數值)

(3)計算該樣品中純堿的質量分數(寫出計算過程)。
(一)(1)除去海水中的氯化鎂(1分)
(2)過濾(1分)
(3)CaCO3(1分)、BaCO3(1分)
(4)除去濾液中的NaOH(1分)和Na2CO3(1分)
(二)(1)2NaHCO3 Na2CO3+CO2↑+H2O(1分)
Na2CO3+CO2↑+H2O(1分)
(2)NaCl(1分)
(三) (1)促使純堿與鹽酸充分反應(1分),
同時有利于二氧化碳的散逸。(1分)
(2)8.8 (圖形正確1分,共2分)
(3)96.4% (3分)
(過程1分,碳酸鈉質量1分,質量分數1分)
解析:(一)(1)加入氫氧化鈉的目的是除去海水中的氯化鎂,使其轉化為氫氧化鎂沉淀而除去;(2)操作一的名稱是過濾;(3)操作1所得的沉淀是混合物,其成分有:BaSO4、Mg(OH)2、CaCO3 、 BaCO3 ;
(4)向濾液中滴加適量稀鹽酸的目的是除去濾液中的NaOH和碳酸鈉。
(二)(1)加熱晶體碳酸氫鈉獲得純堿的化學方程式為:2NaHCO3 Na2CO3+CO2↑+H2O;(2)向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀,說明溶液中還有氯離子,故填:氯化鈉。
Na2CO3+CO2↑+H2O;(2)向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀,說明溶液中還有氯離子,故填:氯化鈉。
(三)(1)某同學認為,在上述純堿含量測定過程中,用玻璃棒不斷攪拌,能使測定誤差減小,其理由促使純堿與鹽酸充分反應,同時有利于二氧化碳的散逸;
(2)圖甲中的曲線上的A點表示加入稀鹽酸前燒杯中樣品和水的質量和;B點表示稀鹽酸將碳酸鈉全部轉化成了碳酸氫鈉,該過程中不產生二氧化碳;C點表示稀鹽酸將碳酸氫鈉全部轉化成了氯化鈉、水和二氧化碳,若再加入稀鹽酸,不再產生二氧化碳.根據上述含義可以畫出產生二氧化碳的質量隨加入稀鹽酸質量的變化曲線如圖:

(3)設樣品中碳酸鈉的質量為x,
根據Na2CO3+HCl═NaHCO3+NaCl;NaHCO3+HCl═H2O+CO2↑+NaCl可得
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
x 100g×14.6%
106/x =73/ (100g×14.6%) 解得x=21.2g,
樣品中碳酸鈉的質量分數為21.2g/ 22g ×100%=96.4%.
答:樣品中碳酸鈉的質量分數為96.4%。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源:2012屆江蘇省蘇州工業園區星海中學九年級中考二模化學試卷(帶解析) 題型:計算題
(15分) 某制堿廠以海水為主要原料生產純堿(碳酸鈉)和其他副產品。
(一)將海水進行處理后獲得精鹽水。海水中,除氯化鈉外,還含有氯化鎂、氯化鈣、硫酸鈉等雜質。其處理的主要流程如下: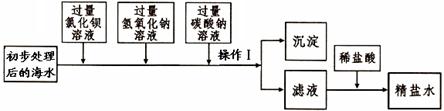
(1)加入氫氧化鈉溶液的目的是 。
(2)操作Ⅰ的名稱是 。
(3)操作1所得的沉淀是混合物,其成分有:BaSO4、Mg(OH)2、 (填化學式)。
(4)向濾液中滴加適量稀鹽酸的目的是 。
(二)將精鹽水制成飽和溶液,先向其中通入足量的氨氣,再向其中通入足量的二氧化碳至有大量晶體(碳酸氫鈉,NaHCO3)析出,反應的化學方程式為NaCl +NH3+CO2+H2O=NH4Cl+NaHCO3↓;將晶體轉移出來后,加熱至不再有氣體產生,所得固體即為純堿。
(1)加熱晶體碳酸氫鈉獲得純堿的化學方程式為 。
(2)稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化;另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀,根據上述實驗可確定純堿樣品含有雜質 (寫化學式)。
(三)為測定上述方法獲得的純堿產品中碳酸鈉的純度。某研究性學習小組對純堿產品進行檢測。取22克該樣品于燒杯中,加水將其溶解,然后逐滴加入溶質質量分數為14.6%的稀鹽酸并不斷振蕩。通過查閱資料得知,在滴加鹽酸過程中首先發生的反應是:Na2CO3+HCl=NaHCO3+NaCl;然后發生的反應是:NaHCO3+HCl= NaCl+H2O+CO2↑.,在上述過程中燒杯中溶液質量與加入稀鹽酸質量的關系如圖甲所示:.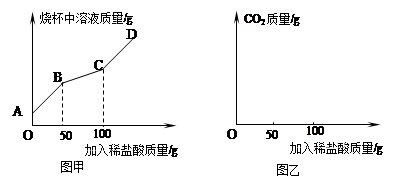
(1)某同學認為,在上述純堿含量測定過程中,用玻璃棒不斷攪拌,能使測定誤差減小,其理由是 。
(2)請你根據圖甲提供的信息,在圖乙的坐標系中畫出檢測過程中產生CO2的質量隨滴加鹽酸質量的變化曲線。(標明二氧化碳質量的相應數值)
(3)計算該樣品中純堿的質量分數(寫出計算過程)。
查看答案和解析>>
科目:初中化學 來源:2011-2012學年江蘇省九年級中考二模化學試卷(解析版) 題型:計算題
(15分) 某制堿廠以海水為主要原料生產純堿(碳酸鈉)和其他副產品。
(一)將海水進行處理后獲得精鹽水。海水中,除氯化鈉外,還含有氯化鎂、氯化鈣、硫酸鈉等雜質。其處理的主要流程如下:

(1)加入氫氧化鈉溶液的目的是 。
(2)操作Ⅰ的名稱是 。
(3)操作1所得的沉淀是混合物,其成分有:BaSO4、Mg(OH)2、 (填化學式)。
(4)向濾液中滴加適量稀鹽酸的目的是 。
(二)將精鹽水制成飽和溶液,先向其中通入足量的氨氣,再向其中通入足量的二氧化碳至有大量晶體(碳酸氫鈉,NaHCO3)析出,反應的化學方程式為NaCl +NH3+CO2+H2O=NH4Cl+NaHCO3↓;將晶體轉移出來后,加熱至不再有氣體產生,所得固體即為純堿。
(1)加熱晶體碳酸氫鈉獲得純堿的化學方程式為 。
(2)稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化;另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO3,再滴加AgNO3溶液,有白色沉淀,根據上述實驗可確定純堿樣品含有雜質 (寫化學式)。
(三)為測定上述方法獲得的純堿產品中碳酸鈉的純度。某研究性學習小組對純堿產品進行檢測。取22克該樣品于燒杯中,加水將其溶解,然后逐滴加入溶質質量分數為14.6%的稀鹽酸并不斷振蕩。通過查閱資料得知,在滴加鹽酸過程中首先發生的反應是:Na2CO3+HCl=NaHCO3+NaCl;然后發生的反應是:NaHCO3+HCl= NaCl+H2O+CO2↑.,在上述過程中燒杯中溶液質量與加入稀鹽酸質量的關系如圖甲所示:.

(1)某同學認為,在上述純堿含量測定過程中,用玻璃棒不斷攪拌,能使測定誤差減小,其理由是 。
(2)請你根據圖甲提供的信息,在圖乙的坐標系中畫出檢測過程中產生CO2的質量隨滴加鹽酸質量的變化曲線。(標明二氧化碳質量的相應數值)

(3)計算該樣品中純堿的質量分數(寫出計算過程)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com