

分析 (1)由富馬酸亞鐵的化學式C4H2FeO4可知,它的相對分子質量=(碳的相對原子質量×碳原子個數)+(氫的相對原子質量×氫原子個數)+(鐵的相對原子質量×鐵原子個數)+(氧的相對原子質量×氧原子個數);
(2)根據化合物中各元素質量比=各原子的相對原子質量×原子個數之比,進行分析;
(3)根據2包補鐵劑及每包含富馬酸亞鐵的質量及富馬酸亞鐵中鐵元素的質量分數和硫酸亞鐵中鐵元素的質量分數來計算.
解答 解:(1)富馬酸亞鐵的相對分子質量為12×4+1×2+56+16×4=170,故填:170;
(2)富馬酸亞鐵中碳、氫元素的質量比為(12×4):(1×2)=24:1;故填:24:1;
(3)每天兒童最大用藥量中含富馬酸亞鐵的質量為0.1g×3=0.3g=300mg,其中含鐵元素:300mg×$\frac{56}{12×4+1×2+56+16×4}$×100%≈98.8mg=0.1g.
若要改服用FeSO4,為了達到同樣的補鐵效果,則每天需要服用FeSO4的質量為:0.1g÷$\frac{56}{56+32+16×4}×100%$=0.3g
故填:0.1;0.3.
點評 本題考查學生利用標簽上物質的化學式進行簡單計算,熟悉常見原子的相對原子質量即可計算解答.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
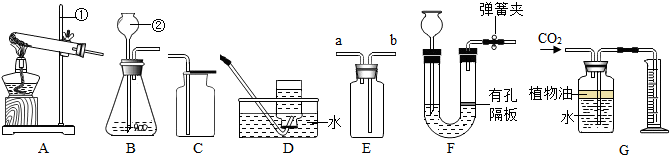
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
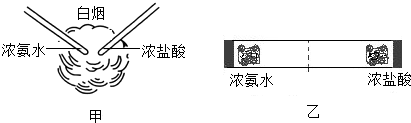
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 如圖是一種家用環保型消毒液發生器,其中發生的主要反應是氯化鈉和水在通電條件下反應生成氫氧化鈉、氯氣和一種氣體單質.已知,在一個化學反應中,如有元素的化合價升高,同時必定有元素的化合價降低.則下列說法錯誤的是( )
如圖是一種家用環保型消毒液發生器,其中發生的主要反應是氯化鈉和水在通電條件下反應生成氫氧化鈉、氯氣和一種氣體單質.已知,在一個化學反應中,如有元素的化合價升高,同時必定有元素的化合價降低.則下列說法錯誤的是( )| A. | 該反應是將電能轉化為化學能 | |
| B. | 該發生器中產生的消毒劑可能是氯氣 | |
| C. | 該反應中的未知氣體單質一定是氫氣 | |
| D. | 電解水實驗中可加入氯化鈉增強導電性 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com