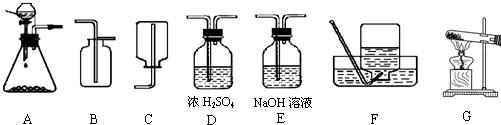
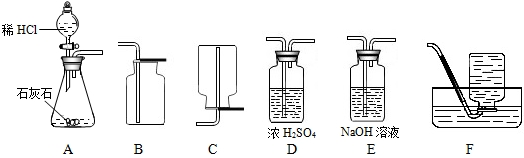
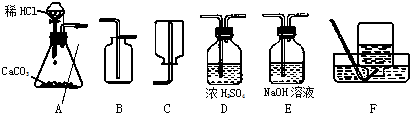
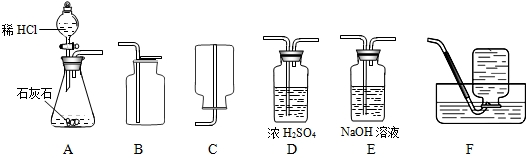
解:(1)實驗室用大理石和稀鹽酸反應制取二氧化碳,反應物的狀是固體和液體,反應條件是常溫,應選用發生裝置A,由于二氧化碳的密度大于空氣的密度,可選用收集裝置B;在收集前用濃硫酸進行干燥.所以可采用的裝置組合是ADB;
(2)實驗室制取CO
2的化學方程式為:CaCO
3 +2HCl═CaCl
2+H
2O+CO
2↑;
(3)若在上述實驗中氣體無法收集滿,則可能的原因是藥品不足、裝置漏氣等;
(4)實驗室制取CO
2,不能將稀HCl換成濃HCl,理由是:因為濃鹽酸會揮發出大量的HCl氣體使制出的氣體不純;
(5)設石灰石中碳酸鈣的質量為x.
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
X 4.4g
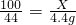
解得:X=10g
石灰石中碳酸鈣的質量分數是
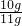
×100%≈90.9%
故答為:(1)ADB; (2)CaCO
3 +2HCl═CaCl
2+H
2O+CO
2↑; (3)藥品不足、裝置漏氣等;(4)不,因為濃鹽酸會揮發出大量的HCl氣體使制出的氣體不純;(5)石灰石中碳酸鈣質量分數是90.9%.
分析:(1)根據實驗室制取二氧化碳的反應物的狀態及反應條件確定發生裝置,根據二氧化碳的收集方法確定收集裝置,制取的二氧化碳常用濃硫酸進行干燥;
(2)根據實驗室制取二氧化碳的反應,寫出反應的方程式;
(3)根據制取二氧化碳的步驟及注意事項分析;
(4)根據濃鹽酸的揮發性進行分析.
(5)根據碳酸鈣與鹽酸反應的方程式由二氧化碳的質量求出碳酸鈣的質量,再求出石灰石中碳酸鈣的質量分數.
點評:該題為實驗室制取二氧化碳的一道綜合題,考查二氧化碳的實驗室制法原理、制取裝置、收集裝置的選擇,以及二氧化碳的某些性質:NaOH溶液能和二氧化碳反應.

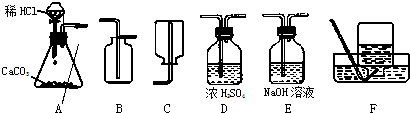
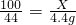 解得:X=10g
解得:X=10g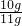 ×100%≈90.9%
×100%≈90.9%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案