
某校化學興趣小組同學用一瓶含有少量氯化鈉的硫酸鈉固體樣品,進行如下圖所示的實驗。
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
請根據以上信息,計算反應后所得溶液中溶質的質量分數。
解:生成BaSO4的質量為:10g + 87g + 54.65g - 140g =" 11.65" g
設樣品中硫酸鈉的質量為x,生成氯化鈉的質量為y
Na2SO4 + BaCl2 =BaSO4↓ + 2NaCl
142 233 117
x 11.65g y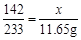
x = 7.1g
y = 5.85g
反應后溶液中溶質的質量為:(10g-7.1g)+ 5.85g = 8.75g
反應后溶液中溶質的質量分數為:
答:反應后所得溶液中溶質的質量分數為6.25%。
解析試題分析:根據質量守恒定律,反應前物質的總質量等于反應后物質的總質量:
Na2SO4的質量+水的質量+ BaCl2溶液的質量= BaSO4沉淀的質量+NaCl質量
BaSO4沉淀不溶于水,不是溶液的質量,故生成BaSO4的質量為:10g + 87g + 54.65g - 140g =" 11.65" g
由BaSO4沉淀的質量,列比例式計算出參加反應的硫酸鈉的質量7.1g,求出樣品中含有NaCl的質量10g-7.1g="2.9" g 再加上生成NaCl的質量就是反應后溶質的總質量:反應后溶液中溶質的質量為:2.9 g + 5.85g = 8.75g
根據溶質的質量分數= ×100%=
×100%=
考點:化學方程式的計算、溶質的質量分數計算


科目:初中化學 來源: 題型:計算題
向碳酸鈉和氯化鈉的混合物15.6 g中加入100 g稀鹽酸,恰好完全反應后,得到111.2 g溶液。試計算:
(1)產生二氧化碳多少克?
(2)所得溶液中溶質的質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
已知燒杯中裝有200g硫酸和硫酸鋅混合溶液,其中含硫酸鋅12.1g.向燒杯中逐漸加入鋅粒,放出氣體質量與加入鋅粒質量的關系如圖所示.當恰好完全反應時,所得的溶液為不飽和溶液.請計算:
(1)m=_________(2)原混合溶液中H2SO4的質量分數為_________.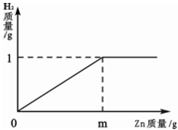
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
實驗室需用氯酸鉀制取氧氣,化學方程式: 2 KClO3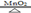 KCl + 3O2↑。現將 29.4g 氯酸鉀與 5.6g 二氧化錳的混合物加熱一段時間后,冷卻,稱量剩余固體的質量為 25.4g。回答:
KCl + 3O2↑。現將 29.4g 氯酸鉀與 5.6g 二氧化錳的混合物加熱一段時間后,冷卻,稱量剩余固體的質量為 25.4g。回答:
(1)生成氧氣的質量是多少?
(2)剩余固體中氯化鉀質量是多少?
(3)固體剩余物中是否還含有氯酸鉀?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
一化學小組為了測定某銅礦中堿式碳酸銅[Cu2(OH)2CO3]的質量分數.稱取該銅礦樣品30g于燒杯中,逐滴滴入質量分數為10%的稀鹽酸至剛好完全反應,共用去稀鹽酸146g.(假設銅礦中的雜質不與稀鹽酸反應,也不溶于水)
試求:
(1)稀鹽酸中HCl的質量是多少克?
(2)銅礦中堿式碳酸銅的質量是多少克?其質量分數是多少?
(3)反應后所得氯化銅溶液中溶質的質量分數是多少?
(反應的化學方程式為:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.反應中各物質的相對分子質量:Cu2(OH)2CO3~222
HCl~36.5 CuCl2~135 CO2~44 H2O~18)
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
將148g氯化鈣溶液與一定量的碳酸鈉溶液混合,恰好完全反應.過濾后,得到20g沉淀和溶質質量分數10%的溶液.求:碳酸鈉溶液中溶質質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某同學對某地工業廢水(含有硫酸和鹽酸)中的H2SO4進行測定.取50g該廢水于燒杯中,加入足量的BaCl2溶液,充分反應中,過濾、洗滌、干燥得到BaSO4固體11.65g.通過計算回答下列問題:
(1)50g該廢水中H2SO4的質量
(2)若改用KOH溶液來測定50g該廢水中H2SO4的含量,結果會 (填“偏高”、“偏低”、“不變”),理由是 .
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某化工廠生產的純堿產品(含有少量氯化鈉)的包裝袋上注明:碳酸鈉≥96%.
為了測定該產品中碳酸鈉的質量分數是否屬實,向4個分別盛有濃度相同、質量均為100g稀鹽酸的燒杯中,分別放入不同質量的純堿產品,充分反應后,稱量燒杯中剩余物的質量,實驗數據如下表:
| 所稱量的物質 | 實驗1 | 實驗2 | 實驗3 | 實驗4 |
| 加入純堿產品質量/g | 2.8 | 5.6 | 11.2 | 14 |
| 燒杯中剩余物質量/g | 101.7 | 103.4 | 106.8 | 109.6 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
某興趣小組的同學對食品中含有的維生素C(化學式為C6H8O6,可表示為Vc)進行探究.
(1)向含有Vc的溶液中滴加紫色石蕊,溶液變紅,說明Vc具有的性質是 .
(2)食品中的Vc被氧氣氧化時,其含量的變化如圖所示,由此可得出的結論有 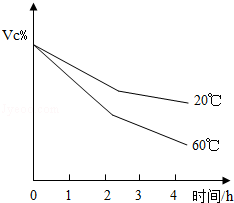
(3)小杰對某果汁飲料中Vc的含量進行測定.反應原理為C6H8O6+I2=C6H6O6+2HI,其中碘元素在反應中的 化合價變化是 .實驗時取果汁飲料10mL,用煮 沸并冷卻的蒸餾水稀釋至50mL,向其中逐滴加入稀碘水至恰好完全反應,測得消耗碘(I2)的質量為25.4mg.則每100mL該果汁飲料中含Vc的質量是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com