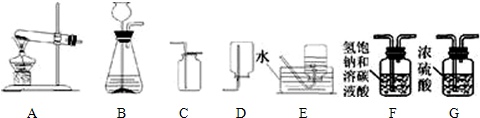
解:(1)實驗室用加熱氯酸鉀或高錳酸鉀制氧氣屬于固體加熱制氣體,故選A;用雙氧水制取氧氣屬于固體和液體制氣體,故選B;
用裝置A制氧氣,需要加熱,可為氯酸鉀或高錳酸鉀的分解,故化學方程式為:2KMnO
4
K
2MnO
4+MnO
2+O
2↑或2KClO
3
2KCl+3O
2↑,若發生裝置選B:2H
2O
2
2H
2O+O
2↑;
(2)明是“將二氧化錳加入裝有過氧化氫溶液的錐形瓶中”,小亮是“把過氧化氫溶液緩緩加入盛有少量二氧化錳的錐形瓶中”,因此為得到平穩的氣流,應采取小亮的做法,以達到通過控制藥品加入而控制反應速度的目的;
(3)利用二氧化碳能使澄清石灰水變渾濁,使用澄清石灰水檢驗二氧化碳反應的化學方程式為CO
2+Ca(OH)
2=CaCO
3↓+H
2O;
(4)將氣體通入新配制的飽和澄清石灰水中,始終未出現渾濁,由于石灰水是新制的,因此不可能是石灰水的原因,那么就只能是所通入氣體的原因;在二氧化碳混入HCl氣體時,能導致此現象的出現,利用HCl能與飽和碳酸氫鈉溶液反應而二氧化碳不能,可選取把氣體通過飽和的碳酸氫鈉溶液除去混在二氧化碳中的HCl氣體,再通入濃硫酸干燥,達到凈化二氧化碳的目的,最后用向上排空氣法收集.
故答案為:
(1)A(或B);若發生裝置選A:2KMnO
4
K
2MnO
4+MnO
2+O
2↑或2KClO
3
2KCl+3O
2↑;
若發生裝置選B:2H
2O
2
2H
2O+O
2↑;
(2)小亮;
(3)CaCO
3↓
(4)F; G; C.
分析:(1)根據實驗室制氧氣的反應原理選擇發生裝置;
(2)將二氧化錳加入裝有過氧化氫溶液的錐形瓶中,反應速度不能得到控制;把過氧化氫溶液緩緩加入盛有少量二氧化錳的錐形瓶中,通過控制加入藥品的速度達到控制反應速度的目的;
(3)檢驗二氧化碳通常采用澄清石灰水,澄清石灰水變渾濁則證明氣體為二氧化碳;
(4)如果二氧化碳氣體中混合HCl,則將氣體通入新配制的飽和澄清石灰水中,也不能出現渾濁,此時可把氣體通過飽和的碳酸氫鈉溶液除去氣體中的HCl,以達到凈化二氧化碳氣體的目的.
點評:掌握正確氧氣的反應原理、裝置和注意事項;了解檢驗和驗滿二氧化碳的方法,根據題意正確書寫化學方程式.

 K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3 2KCl+3O2↑,若發生裝置選B:2H2O2
2KCl+3O2↑,若發生裝置選B:2H2O2 2H2O+O2↑;
2H2O+O2↑; K2MnO4+MnO2+O2↑或2KClO3
K2MnO4+MnO2+O2↑或2KClO3 2KCl+3O2↑;
2KCl+3O2↑; 2H2O+O2↑;
2H2O+O2↑; 



