
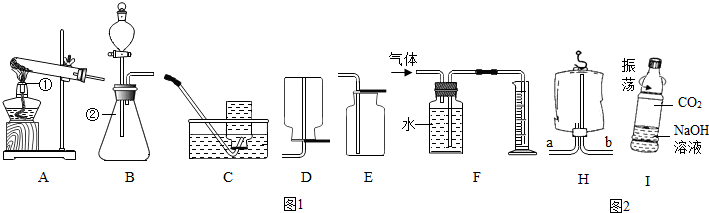
 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;從分液漏斗流下的雙氧水占有一定的體積;(4)b;(5)將氫氧化鈉溶液溶液換成等體積的蒸餾水作對比試驗;CO2+2NaOH=Na2CO3+H2O.
2H2O+O2↑;從分液漏斗流下的雙氧水占有一定的體積;(4)b;(5)將氫氧化鈉溶液溶液換成等體積的蒸餾水作對比試驗;CO2+2NaOH=Na2CO3+H2O.

 智能訓練練測考系列答案
智能訓練練測考系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
| 大部分 |
| 小部分 |
| NaOH溶解放熱 |
| NaOH溶解放熱 |
| H2SO4 |
| △ |
查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:2011-2012學年福建省福州市福清市元樵中學九年級(上)期末化學練習試卷(解析版) 題型:解答題
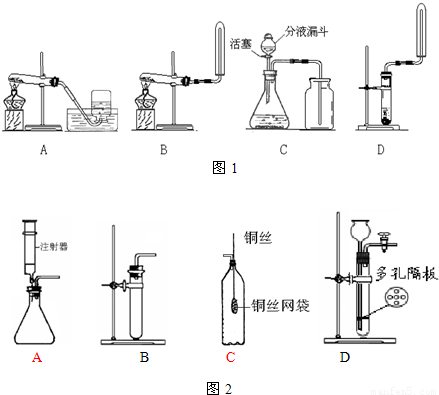
查看答案和解析>>
科目:初中化學 來源:2006年江蘇省蘇州中學國際班提前招生化學試卷(解析版) 題型:填空題
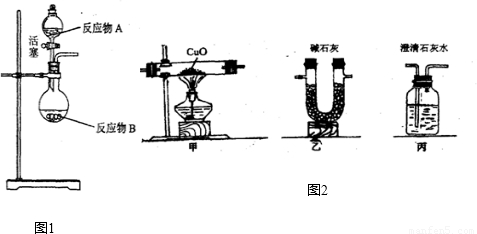
 NH3?H2O
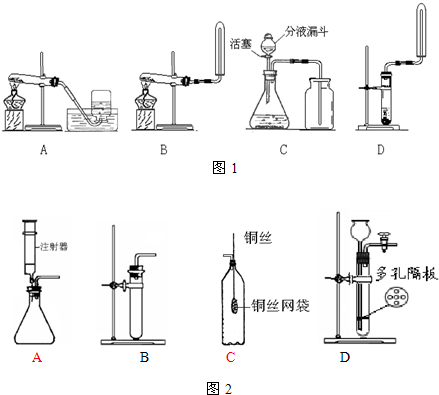
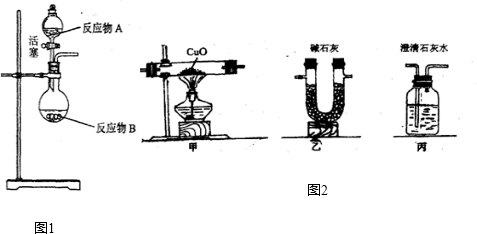
NH3?H2O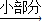 NH4++OH-,氨水中主要溶質微粒是NH3?H2O,NH3?H2O不穩定,受熱條件下易分解放出氨氣.另外,上述反應可逆反應(即在相同條件下能同時向左右兩個方向進行的反應),增加反應物的濃度,能促使反應向右進行,增加產物的濃度,能促使反應向左進行.某同學用濃氨水和另一種固體物質制取氨氣,反應物A為濃氨水,反應物B為 固體,用該方法制取氨氣的原理為 (用文字表述).
NH4++OH-,氨水中主要溶質微粒是NH3?H2O,NH3?H2O不穩定,受熱條件下易分解放出氨氣.另外,上述反應可逆反應(即在相同條件下能同時向左右兩個方向進行的反應),增加反應物的濃度,能促使反應向右進行,增加產物的濃度,能促使反應向左進行.某同學用濃氨水和另一種固體物質制取氨氣,反應物A為濃氨水,反應物B為 固體,用該方法制取氨氣的原理為 (用文字表述).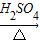 CO2↑+CO↑+H2O.若用圖2所示的發生裝置進行實驗,還需要添加的儀器有酒精燈、鐵圈和 .某同學為檢驗混合氣體中的CO,將所得混合氣體依次通過乙、丙、甲、丙,尾氣點燃,其中第一次通過丙的作用是 .
CO2↑+CO↑+H2O.若用圖2所示的發生裝置進行實驗,還需要添加的儀器有酒精燈、鐵圈和 .某同學為檢驗混合氣體中的CO,將所得混合氣體依次通過乙、丙、甲、丙,尾氣點燃,其中第一次通過丙的作用是 .查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com