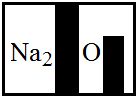
(2013?信陽一模)某化學興趣小組在實驗室發現了一瓶標簽受到腐蝕(如圖所示)的溶液,他們對此產生了興趣.
[提出問題]這瓶溶液究竟是什么?
經過詢問實驗老師平時的藥品保管得知,這瓶無色溶液應該是碳酸鈉、碳酸氫鈉、氯化鈉、硫酸鈉、硝酸鈉中的某一種.為了確定該藥品,他們首先進行了理論分析:
(1)小明根據標簽上的組成元素認為一定不可能是
NaCl
NaCl
.
(2)小英提出,碳酸氫鈉、硝酸鈉也不可能,你認為她的依據是
這二者的化學式中Na元素的右下角不會有2
這二者的化學式中Na元素的右下角不會有2
.
[設計實驗]為了確定該溶液究竟是剩余兩種鹽的哪一種,他們設計了如下實驗.
| 實驗操作 |
實驗現象 |
| (1)取少量樣品于試管中,慢慢滴加BaCl2溶液 |
出現白色沉淀 |
| (2)靜置一段時間后,傾去上層清液,向沉淀中繼續滴加稀鹽酸 |
白色沉淀全部溶解,產生大量氣泡 |
[實驗結論]
(3)該瓶無色溶液是
Na2CO3
Na2CO3
.生成白色沉淀過程的化學方程式是
BaCl2+Na2CO3═BaCO3↓+2NaCl
BaCl2+Na2CO3═BaCO3↓+2NaCl
.
[實驗反思]
(4)小強認為上述設計實驗還可簡化,仍能達到目的.小強的實驗操作是
取少量無色溶液樣品于試管中,慢慢滴加稀鹽酸
取少量無色溶液樣品于試管中,慢慢滴加稀鹽酸
.
(5)經查閱資料得知上述五種鹽里碳酸鈉、碳酸氫鈉的溶液呈堿性,其余三種鹽的溶液呈中性,請你再設計一種實驗方法,確定該溶液究竟是哪種鹽.簡述實驗操作和現象.
(6)[綜合計算]現取含有氯化鈉雜質的純堿樣品25g放入燒杯中,向其中加入50g稀鹽酸,二者恰好完全反應.反應結束后稱量燒杯中剩余物質的總質量為66.2g(不包括燒杯的質量,且氣體的溶解忽略不計).試計算純堿樣品中雜質氯化鈉的質量分數.

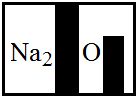 (2013?信陽一模)某化學興趣小組在實驗室發現了一瓶標簽受到腐蝕(如圖所示)的溶液,他們對此產生了興趣.
(2013?信陽一模)某化學興趣小組在實驗室發現了一瓶標簽受到腐蝕(如圖所示)的溶液,他們對此產生了興趣.

 名校課堂系列答案
名校課堂系列答案