
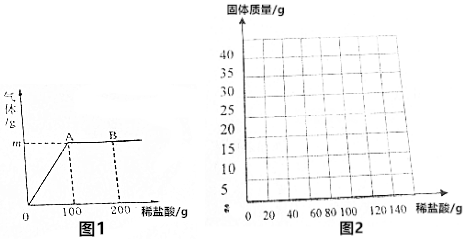
分析 (1)根據在金屬活動性順序中,氫前的金屬能與酸發生置換反應生成氫氣分析;加入100克稀鹽酸時,反應已經結束.再加入稀鹽酸時,反應不再進行.
(2)根據圖中信息判斷生成氫氣的質量,根據化學方程式可以計算鋅的質量即可解答.
(3)根據反應結束后加入稀鹽酸的質量與剩余的質量關系分析.
解答 解:(1)只給出鹽酸和必要的儀器,則合金中需含有能與鹽酸反應的金屬,鋅排在氫的前面,而銅和銀排在氫的后面,不與鹽酸反應,所以只能測出銅鋅合金.
故本題答案為:Cu~Zn;
(2)①點產生氣體的質量為:32.5g+100g-132.1g=0.4g.B點時反應結束,這時的溶質是氯化鋅,再加入稀鹽酸時溶質又多了氯化氫,這時的溶液中含有氯化鋅和氯化氫,
故填:0.4.ZnCl2、HCl.
②設生成0.4g氫氣需要鋅的質量為x,則有
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.4g
$\frac{65}{x}=\frac{2}{0.4g}$
解之得:x=13g;
合金中銅的質量分數為:$\frac{32.5g-13g}{32.5g}×$100%=60%
答:該合金中銅的質量分數為60%.
③合金開始的質量為32.5g,加入稀鹽酸后鋅與酸反應,使固體質量減少,由(2)計算可知加入100克稀鹽酸時,反應已經結束,消耗鋅的質量為13g;剩余固體質量為:32.5g-13g=19.5g;故Cu-Zn合金質量隨加稀鹽酸質量變化關系圖為:
答案: .
.
點評 本題是一種綜合性的題型,將溶液、化學反應和圖象融合在一起,有一定的難度,要求比較高.通常學生在計算時常常會忽視了實際參加反應的是溶液中溶質的質量,而往往會把數據直接代入化學方程式進行計算.這就要求學生足夠細心、會分析、且條理分明.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:選擇題
| A. | 它可用作散熱材料 | B. | 它的硬度小于金剛石 | ||
| C. | 它可用作新型電池的電極 | D. | 它完全燃燒生成二氧化碳 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
 (1)知某化學式為MCO3的相對分子質量為100.
(1)知某化學式為MCO3的相對分子質量為100.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
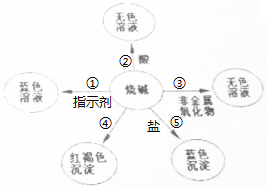 (1)請你在編號①、⑤處各填入一種物質;①是石蕊試液⑤是硫酸銅.
(1)請你在編號①、⑤處各填入一種物質;①是石蕊試液⑤是硫酸銅.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | NiSO4溶液 | B. | CuSO4溶液 | C. | Na2CO3溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 某天然礦泉水中元素及物質含量如下表所示,請用相關化學用語回答下列問題.
某天然礦泉水中元素及物質含量如下表所示,請用相關化學用語回答下列問題. | 礦泉水中主要成分(mg/L) | |
| 偏硅酸(H2SiO3)30-50 硫酸根3-8 氯離子1-5 | 鈣7-20 鈉3-16 鉀2-8 鎂6-20 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com