
【題目】牙膏是人們生活中的必需品,在牙膏生產過程中常添加一種摩擦劑.這種摩擦劑是一種經過一系列加工而制得的極細的碳酸鈣粉末.其生產過程如圖.
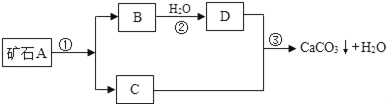
根據上圖回答:
(1)寫出B,C,兩種物質的化學式:B_____; C_____;
(2)寫出上述過程中反應①的化學方程式_____.上述過程中沒有涉及的基本反應類型是_____
(3)許多牙膏中都含有_____元素,因為如果缺少這種元素,就容易得齲齒.
【答案】(1)CaO; CO2;(2)CaCO3![]() CaO+CO2↑. 置換反應和復分解反應
CaO+CO2↑. 置換反應和復分解反應
(3)氟
【解析】
試題(1)由圖可知,礦石A能生成B和C,則A可能是碳酸鈣,生成的B和C可能為氧化鈣和二氧化碳,B能和水反應生成D,D與C反應生成和碳酸鈣和水,則D為氫氧化鈣,C為二氧化碳,B為氧化鈣,化學式為CaCO3,CaO,CO2,Ca(OH)2;(2)碳酸鈣分解生成氧化鈣和二氧化碳屬于分解反應,化學方程式為:CaCO3![]() CaO+CO2↑.反應②為氧化鈣與水化合生成氫氧化鈣,屬于化合反應,反應③是二氧化碳與氫氧化鈣反應生成碳酸鈣和水,此反應不屬于基本反應類型,因此該過程中沒有涉及到的反應類型為復分解反應和置換反應(3)氟元素能防治齲齒,如果缺少氟元素就容易得齲齒,因此許多牙膏中都含有氟元素
CaO+CO2↑.反應②為氧化鈣與水化合生成氫氧化鈣,屬于化合反應,反應③是二氧化碳與氫氧化鈣反應生成碳酸鈣和水,此反應不屬于基本反應類型,因此該過程中沒有涉及到的反應類型為復分解反應和置換反應(3)氟元素能防治齲齒,如果缺少氟元素就容易得齲齒,因此許多牙膏中都含有氟元素


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】為了測定某稀硫酸的溶質的質量分數,設計了如圖1實驗方案。
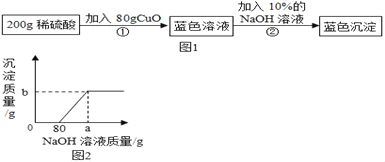
第②步實驗測得的部分數據見圖2:
(1)分析第②步實驗:首先與80g NaOH溶液反應的物質是_____(填化學式)
(2)計算稀硫酸的溶質的質量分數是多少?_____(寫出具體計算過程)
(3)a的讀數為_____,b的讀數為_____。
(4)將最后得到的藍色沉淀經洗滌、烘干后,充分加熱得到黑色固體CuO質量為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】小華將一張濾紙在某示劑中浸泡后晾干,用蘸有氫氧化鈉溶液的玻璃棒在上面寫“化學”兩字,立刻顯紅色。再將其懸掛于鐵架臺上,并在濾紙的下方(如圖)放置一個盛有某溶液的燒杯,過一會兒,發現紅色的字消失,則濾紙上的指示劑和燒杯中的溶液分別是( )
A | B | C | D | |
濾紙上的指示劑 | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
燒杯中的溶液 | 濃氨水 | 濃鹽酸 | 濃氨水 | 濃鹽酸 |
A. A
B. B
C. C
D. D
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在一支試管中放入一小段鎂條(已擦去氧化膜),再向試管中加入一定量的鹽酸,鎂條表面有_____產生,反應的化學方程式是_____。
[發現問題]為了再次觀察上述反應現象,小林同學用較長的鎂條重做上述實驗,但發現了異常現象,試管中出現了白色沉淀。
[實驗驗證1]小林同學針對兩次實驗的不同,設計對比實驗方案,探究出現異常現象的原因。
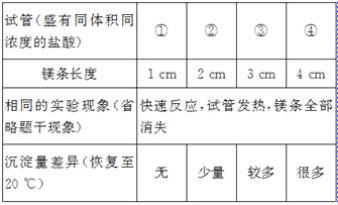
[得出結論]鎂條與鹽酸反應產生白色沉淀與_____有關。
[追問]白色沉淀是什么物質?
[查閱資料]①20 ℃時,100 g水中最多能溶解氯化鎂54.8 g;
②鎂能與熱水反應產生一種堿和氫氣;
③氯化銀既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:鎂;猜想二:氯化鎂;猜想三:氫氧化鎂,猜想的依據是_____(用化學方程式表示)。
[實驗驗證2]將白色沉淀洗滌干凈,分別取少量沉淀于A、B、C試管中,進行如表實驗:
試管 | 操作 | 現象 | 結論 |
A | 加入足量鹽酸 | _____,白色沉淀_____ | 猜想一不正確,但這種白色沉淀能溶于鹽酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正確 |
C | 加入適量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的離子是:Mg2+、_____ |
繼續滴加幾滴硝酸銀溶液 | 出現大量白色沉淀 |
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學興趣小組根據右圖所示進行模擬煉鐵的實驗,并對產物成分進行探究。
經初步無色氣體A不含有單質氣體,黑色粉末B含有兩種單質中的一種或者兩種。
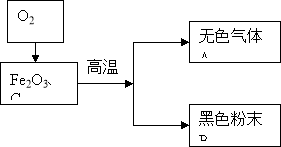
高爐煉鐵的原理為:Fe2O3+3CO![]() 2Fe+3CO2,請寫出反應器中一氧化碳是如何產生的化學方程式: 。
2Fe+3CO2,請寫出反應器中一氧化碳是如何產生的化學方程式: 。
興趣小組又分成甲乙兩組分別對無色氣體A和黑色粉末B的成分進行探究。
【猜想與假設】
甲組在分析了煉鐵的原理后,認為無色氣體A中可能有CO2,也可能有未反應的 。
乙組認為黑色粉末的成分中存在以下三種情況:
假設一:只含有鐵。 假設二:只含有 。 假設三:以上兩種物質都含有。
【實驗探究】
(1)為驗證甲組的猜想,大家按下圖示進行實驗(箭頭表示氣體流向):
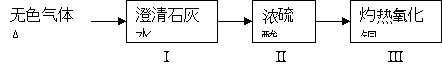
當看到Ⅰ中澄清石灰水變渾濁,Ⅲ中灼熱的氧化銅變紅,可以確定無色氣體A的成分為: ,Ⅱ中濃硫酸的作用是: 。
(2)為驗證乙組中假設三成立,大家用物理和化學兩種方法來進行探究
實驗方法 | 實驗操作 | 實驗現象 | 實驗結果 |
物理方法 | 假設三成立 | ||
化學方法 | 取少量黑色粉末B于試管中,加入過量的稀鹽酸 | 假設三成立 |
寫出黑色粉末B中加入過量的稀鹽酸反應的化學方程式: 。
【交流反思】
在做甲組的實驗中發現其存在一個很不環保的缺陷,請指出來 。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖是a、b、c三種物質的溶解度曲線,下列說法正確的是
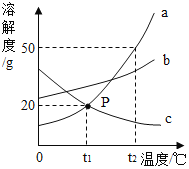
A. P點表示t1℃時,a、c飽和溶液中溶質質量相等
B. t2℃時,將30ga物質加入到50g水中充分攪拌,得到80ga的飽和溶液
C. t2℃時等質量的三種飽和溶液降溫至t1℃,所得溶液中溶劑質量c>b>a
D. 將t1℃時a、b、c三種物質的溶液分別升溫至t2℃,其溶質質量分數都不可能發生變化
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在2018全國兩會上,農業部部長韓長賦在人民大會堂“部長通道”回答記者提問時說,農藥和化肥確實對糧食增產發揮了重要作用,“十三五”開始,我國大力開展農藥減量,效果明顯。2016年,全國農藥使用量負增長。
談到農藥,人們可能想到農藥對人體健康和環境的危害,其實農藥在農業生產上起著重要的作用。目前市售蔬菜農藥殘留量雖然已達到國家標準,但通過科學的清洗方法仍可進一步降低農藥殘留。
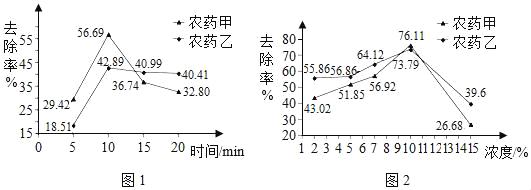
實驗人員分別選取含甲、乙農藥的蔬菜,研究了不同的清洗方法對農藥的去除率的影響。
清水浸泡。圖1呈現出兩種農藥的去除率隨浸泡時間的變化。
洗潔精清洗。實驗選擇了6種洗潔精進行測試,結果表明多數洗潔精對農藥的去除率可達到60%以上,最高可達到84%。
堿性溶液。浸泡食用堿溶液有利于農藥分解,圖2表示不同濃度的食用堿溶液對農藥的去除率的影響。
希望同學們可以選擇科學的清洗方法,更加安全的食用蔬菜。
依據文章內容,結合所學化學知識,回答下列問題。
(1)農藥和化肥對糧食增產發揮了重要作用,請你寫出一種氮肥:_____(合理即可)。
(2)依據圖1分析去除農藥殘留的最佳浸泡時間是_____。
(3)食用堿主要是碳酸鈉和碳酸氫鈉,它們的溶液的pH_____7(填“>”或“<”)。測定溶液pH的正確方法是_____。
(4)用食用堿溶液浸泡含有農藥甲的蔬菜時,要想超過清水浸泡的最大去除率,可以選取的濃度是_____(填序號,下同)。
A 2% B 5% C 10% D 15%
(5)下列說法正確的是_____。
A 采用清水浸泡去除農藥的時間不宜過長
B 多數洗潔精對農藥的清洗效果比清水浸泡的好
C 食用堿的去除效果較好,是因為在浸泡過程中農藥發生了化學變化
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下列實驗操作能達到預期目的是( )
①用20mL水和20mL酒精配制成40mL酒精溶液;
②用量筒量取5.62mL的水;
③用托盤天平稱量5.6gNaCl固體;
④用托盤天平、燒杯、量筒、玻璃捧配制一定溫度下30%的NaCl的溶液.
A. ③B. ③④C. ②③D. ①④
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學小組利用如圖所示裝置(圖中固定裝置已略去)測定銅鋅合金中鋅的質量分數,探究過程如下:
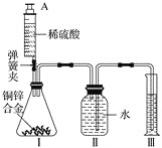
①連接實驗裝置并檢查裝置氣密性。
②向裝置Ⅰ中的錐形瓶加入2.0g的銅鋅合金樣品粉末,由注射器緩緩注入稀硫酸,待到錐形瓶中不再產生氣體時,準確讀取注射器內讀數,減少10.5mL稀硫酸,同時立即夾緊彈簧夾,移出裝置Ⅲ中的導管,準確讀取量筒內水的體積為214.0mL(注:樣品中的雜質不參加反應
③裝置Ⅰ中剩余固體物質經過適當處理后,準確稱量其質量為1.4g
④該小組的三位同學利用實驗過程測得不同數據,計算銅鋅合金樣品中鋅的質量分數
甲同學利用裝置Ⅰ中反應前后固體的質量進行計算;
乙同學利用裝置Ⅰ中加入稀硫酸的量進行計算;
丙同學利用裝置Ⅲ中量取水的體積進行計算,并查得:在標準狀況下,氫氣的密度為0.09gL-1。
回答下列問題:
(1)裝置Ⅰ中反應的化學方程式為___,實驗過程中須加入稀硫酸至不再產生氣體,目的是___。
(2)步驟③中稱量剩余固體之前的正確操作是_______、洗滌、干燥。
(3)根據實驗測定的數據,上述三位同學中________(填“甲”、“乙”或“丙”)同學無法進行計算樣品中鋅的質量分數。
(4)化學小組同學發現:按照丙同學的方案進行計算,致使實驗結果出現較大偏差。以下因素可能造成偏差的有________(填標號)。
A 移出裝置Ⅲ時,導管內留存了一部分水
B 實驗測量前,沒有排除裝置Ⅰ中的空氣
C 數據處理時,未排除加入稀硫酸所占的體積
【答案】(1)![]() ;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
【解析】
試題(1)由于銅排在了氫的后面,所以與酸不反應,反應物是鋅和硫酸,生成物是硫酸鋅和氫氣,氫氣后面標上上升符號;實驗過程中須加入稀硫酸至不再產生氣體,目的是使樣品中的鋅完全反應;(2)從銅和硫酸鋅溶液的混合物中得到銅,先進行過濾,得到帶有硫酸鋅溶液的銅,再進行洗滌除去表面的硫酸鋅,再進行干燥除去水即可;(3)根據加入稀硫酸的量進行計算需要知道稀硫酸的溶質質量分數,而題中沒有告知;(4)由于鋅與硫酸反應生成硫酸鋅和氫氣時,放出熱量,如果沒等冷卻到室溫,根據熱漲冷縮的原理可知進入量筒中水偏多,所以誤認為得到的氫氣多,再就是數據處理時,未排除加入稀硫酸所占的體積,計算的結果就偏大;
考點:金屬的化學性質;化學方程式;實驗誤差分析;
點評:熟記金屬活動性順序表,知道排在氫之前的金屬和稀鹽酸或者硫酸反應生成氫氣,而排中氫之后的金屬和稀鹽酸或者稀硫酸不生成氫氣;化學反應中物質的質量比都是純凈物之間的質量比,而溶液中溶質的質量=溶液質量×溶質質量分數;本題容易出錯的地方是對實驗結果的評價,要知道鋅與硫酸反應放出熱量,會造成相應的誤差,必須冷卻到室溫才能進行觀察和計算。
【題型】實驗題
【結束】
30
【題目】用1000t含氧化鐵80%的赤鐵礦石,理論上可以煉出含鐵96%的生鐵的質量是多少?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com