
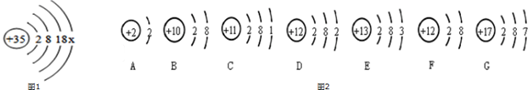
分析 (1)根據原子中核內質子數等于核外電子數分析X的值,根據最外層電子數目的特點分析的是電子的情況,寫出形成的離子的符號;
(2)根據同種元素的質子數相同、相對穩定結構的特點和決定元素化學性質的微粒考慮.
解答 解:(1)原子中核內質子數等于核外電子數,即:35=2+8+18+X,所以X=7;由于最外層電子數是7大于4,易得到一個電子形成溴離子,符號為:Br-;
(2)由圖2表示的微粒可知,DF微粒的質子數相同,屬于同一種元素;A、B的微粒核內質子數等于核外電子數,屬于原子,最外層電子數達到了穩定結構,性質相似;G的最外層電子數與Br的相同,化學性質相似;圖F表示的元素是鎂元素,原子的核外有三個電子層,位于元素周期表的第三周期.
故答案為:(1)7;Br-;(2)DF;AB;G;三.
點評 解答本題關鍵是要知道原子結構示意圖中核內質子數等于核外電子數,知道金屬元素的判斷方法,知道相對穩定結構的特點.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 化學是一門以實驗為基礎的科學,實驗是學習化學的一條重要途徑.根據以下實驗解答下列問題:
化學是一門以實驗為基礎的科學,實驗是學習化學的一條重要途徑.根據以下實驗解答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
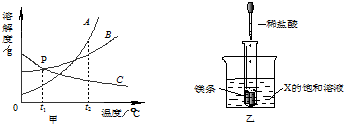
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com