一化學小組為了測定某銅礦中堿式碳酸銅[Cu2(OH)2CO3]的質量分數.稱取該銅礦樣品30g于燒杯中,逐滴滴入質量分數為10%的稀鹽酸至剛好完全反應,共用去稀鹽酸146g.(假設銅礦中的雜質不與稀鹽酸反應,也不溶于水)試求:
(1)稀鹽酸中HCl的質量是多少克?
(2)銅礦中堿式碳酸銅的質量是多少克?其質量分數是多少?
(3)反應后所得氯化銅溶液中溶質的質量分數是多少?
(反應的化學方程式為:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O)
解:(1)稀鹽酸中HCl的質量為:146g×10%=14.6g
(2)設需要Cu
2(OH)
2CO
3的質量為x;生成CuCl
2的質量為y;CO
2的質量為a
Cu
2(OH)
2CO
3+4HCl═2CuCl
2+CO
2↑+3H
2O
222 146 270 44
x 14.6g y a

=

解得:x=22.2g;y=27g;a=4.4g
(2)銅礦中堿式碳酸銅的質量分數為:

×100%=74%
(3)反應后所得氯化銅溶液中溶質的質量分數是為:
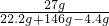
×100%=16.5%
答:(1)稀鹽酸中HCl的質量是14.6g.
(2)銅礦中堿式碳酸銅的質量是22.2g,其質量分數是74%.
(3)反應后所得氯化銅溶液中溶質的質量分數是16.5%.
分析:(1)根據題目信息可知,稀鹽酸的溶質的質量=溶液的質量×溶質的質量分數.
(2)根據鹽酸中溶質的質量結合反應的化學方程式可計算出堿式碳酸銅的質量.
(3)根據鹽酸中溶質的質量結合反應的化學方程式可以計算出反應中生成的氯化銅的質量,然后根據溶液中溶質的質量分數的計算公式進行計算即可.
點評:掌握化學方程式的計算格式和規范性,本題的關鍵是計算出反應后溶液的質量,注意不要漏掉生成的二氧化碳的質量.

 =
=
 ×100%=74%
×100%=74%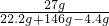 ×100%=16.5%
×100%=16.5%

 新課標同步訓練系列答案
新課標同步訓練系列答案