
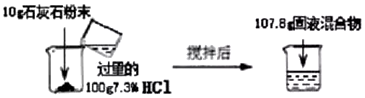
分析 (1)根據溶質質量不變原理分析計算;
(2)根據碳酸鈣與稀鹽酸反應生成氯化鈣、水和二氧化碳寫出反應的化學方程式;
(3)根據質量守恒定律,燒杯內減少的質量即生成的二氧化碳質量,據此根據反應的化學方程式列出碳酸鈣質量的比例式,求出碳酸鈣的質量,氯化鈣的質量,求出石灰石中碳酸鈣質量分數.
(4)根據溶質質量分數計算出濾液中氯化鈣的質量分數.
解答 解:(1)由溶質質量不變原理和溶質質量分數的計算公式可知,需要質量分數為36.5%的濃鹽酸的質量是
$\frac{100g×7.3%}{36.5%}$=20g;
(2)由質量守恒定律,生成二氧化碳的質量為100g+10g-107.8g=2.2g.
設參加反應碳酸鈣的質量為x,生成氯化鈣的質量為y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 2.2g
$\frac{100}{44}=\frac{x}{2.2g}$ 解得:x=5g
$\frac{111}{44}=\frac{y}{2.2g}$ 解得:y=5.55g
石灰石中碳酸鈣質量分數為:$\frac{5g}{10g}×100%$=50%;
(3)濾液中氯化鈣的質量分數是:$\frac{5.55g}{5g+100g-2.2g-2.8g}×100%$=5.55%.
故答為:(l)20g;(2)CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)$\frac{100}{44}=\frac{x}{2.2g}$,50%; (4)5.55%.
點評 本題難度不大,掌握根據化學方程式的計算即可正確解答本題,根據質量守恒定律計算出二氧化碳的質量是正確解答本題的前提和關鍵.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 酸 | B. | 堿 | C. | 單質 | D. | 氧化物 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | Fe Hg | B. | Fe Zn | C. | Cu Hg | D. | Cu Zn |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com