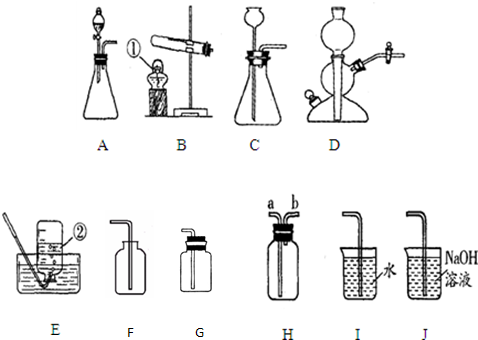
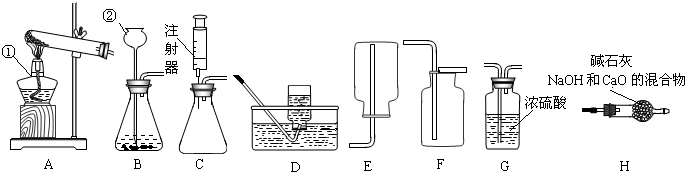
解:(1)圖中儀器a是試管;
(2)實驗室用大理石和鹽酸反應生成氯化鈣、水和二氧化碳,方程式是:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;該反應不需加熱,屬于固液常溫型,故選發生裝置B,二氧化碳的密度比空氣大且能溶于水,所以用向上排空氣法收集;
(3)氯酸鉀在加熱和二氧化錳作催化劑的條件下生成氯化鉀和氧氣,方程式是2KClO
3
2KCl+3O
2↑,該反應需要加熱,屬于固體加熱型,故選發生裝置A;若用盛滿水的F裝置收集氧氣,應從導管②進氣,將水擠壓到集氣瓶底部,從長導管排出;
(4)用加熱無水醋酸鈉和堿石灰的固體混合物的方法制取甲烷,屬于固體加熱型,故選發生裝置A,甲烷難溶于水,其密度比空氣小(相對分子質量=16<29),所以可用排水法或向下排空氣法收集;
(5)設92g金屬鈉理論上可制得含碳96%的金剛石的質量為x
CO
2+4Na

C(金剛石)+2Na
2O
92 12
92g 96%?x
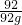
=
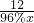
x=12.5g
答:92g金屬鈉理論上可制得含碳96%的金剛石的質量為12.5g.
故答案為:
(1)試管;
(2)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑; B和D;
(3)2KClO
3
2KCl+3O
2↑; A; ②;
(4)AC或AE;
(5)12.5g.
分析:(1)據常用儀器回答;
(2)據實驗室制取二氧化碳的反應原理書寫方程式,并據反應物狀態和反應條件選擇發生裝置,據二氧化碳的密度和溶解性選擇收集裝置;
(3)氯酸鉀在加熱和二氧化錳作催化劑的條件下生成氯化鉀和氧氣,據此書寫方程式,并選擇發生裝置,排水法收集氣體分析解答;
(4)據發生和收集裝置的選取方法分析解答;
(5)根據二氧化碳和金屬鈉的反應,結合題給的金屬鈉的質量可以求算出能夠制得的金剛石的質量.
點評:要想解答好這類題目,首先要掌握發生和收集裝置的選取方法、反應原理,理解和熟記根據化學反應方程式的計算步驟和格式,以及與之相關的知識等.然后,根據所給的問題情景或圖表信息等,結合所學的相關知識和技能,按照題目要求認真分析解答即可.


 C(金剛石)+2Na2O],請計算92g金屬鈉理論上可制得含碳96%的金剛石的質量.
C(金剛石)+2Na2O],請計算92g金屬鈉理論上可制得含碳96%的金剛石的質量. 2KCl+3O2↑,該反應需要加熱,屬于固體加熱型,故選發生裝置A;若用盛滿水的F裝置收集氧氣,應從導管②進氣,將水擠壓到集氣瓶底部,從長導管排出;
2KCl+3O2↑,該反應需要加熱,屬于固體加熱型,故選發生裝置A;若用盛滿水的F裝置收集氧氣,應從導管②進氣,將水擠壓到集氣瓶底部,從長導管排出; C(金剛石)+2Na2O
C(金剛石)+2Na2O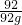 =
=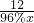
 2KCl+3O2↑; A; ②;
2KCl+3O2↑; A; ②;

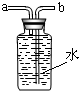 收集乙炔,氣體應從
收集乙炔,氣體應從