實驗室里用加熱氯酸鉀(在催化劑MnO2存在下)的方法制取氧氣.在大試管里加入4.9克的氯酸鉀和0.5克二氧化錳,用排水法收集氧氣.加熱一段時間后,停止加熱,待試管里的殘留固體完全冷卻后,稱的固體質量為4.44克.試求:
(1)制的氧氣是多少克?
(2)已經分解的氯酸鉀的質量分數是多少?
【答案】
分析:依據質量守恒定律結合反應前后固體質量的變化可求生成氧氣的質量,根據氧氣的質量可求出分解的氯酸鉀的質量,進而依據氯酸鉀的總質量可求已經分解的氯酸鉀的質量分數;
解答:解:(1)根據固體質量的減少量就是生成氧氣的質量,因為二氧化錳是這一反應的催化劑反應前后固體質量不變,所以加熱后生成氧氣質量為:4.9g+0.5g-4.44=0.96g;
(2)設要生成0.96g氧氣需要參加反應的氯酸鉀的質量為x則:
2KClO
3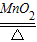
2KCl+3O
2↑
245 96
x 0.96g
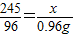
解得x=2.45g
已經分解的氯酸鉀的質量分數是
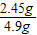
×100%=50%
答:(1)制的氧氣是0.96克;
(2)已經分解的氯酸鉀的質量分數是50%;
點評:此題是對化學反應方程式的考查,解答本題關鍵是要知道固體質量的減少量就是生成氧氣的質量.

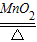 2KCl+3O2↑
2KCl+3O2↑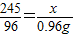
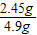 ×100%=50%
×100%=50%
